名校
1 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
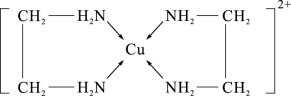
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
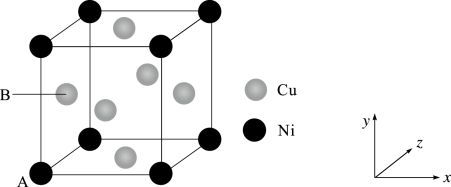
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
984次组卷
|
6卷引用:江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题
江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2022届江西省赣州市高三适应性考试(二模)理综化学试题安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)2021年山东高考化学试题变式题11-20
名校
解题方法
2 . (1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
② 的最高能层电子排布式为
的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A. B.
B. C.
C. D.
D.
(2)二氯甲醛的结构简式为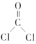 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是___________ 。
(3)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(4)化学上有一种见解,认为含氧酸的通式可以写成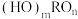 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。
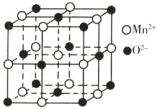
①该晶胞中由 形成的正八面体的空隙数为
形成的正八面体的空隙数为______
②晶胞中距离最近的两个 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和 的代数式表示)。
的代数式表示)。

①配合物中每个中心离子的配位数为
②
 的最高能层电子排布式为
的最高能层电子排布式为③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.
 B.
B. C.
C. D.
D.
(2)二氯甲醛的结构简式为
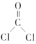 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是(3)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(4)化学上有一种见解,认为含氧酸的通式可以写成
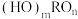 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

①该晶胞中由
 形成的正八面体的空隙数为
形成的正八面体的空隙数为②晶胞中距离最近的两个
 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-04-10更新
|
569次组卷
|
4卷引用:江西省重点中学协作体2021届高三5月第二次联考理综化学试题
解题方法
3 . 据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为______ ,Ni在元素周期表中的位置_______ 。
(2)C、N、O三种元素中电负性最小的是______ (填元素符号),C在形成化合物时,其键型以共价键为主,原因是_______ 。
(3)Ni(NO3)2中阴离子的空间构型是__ ,写出与该阴离子互为等电子体的一种分子的化学式:__ 。
(4)一维链状配位聚合物中,碳原子的杂化形式为_____ 。已知:CH3COOH的沸点为117.9℃,HCOOCH3的沸点为32℃,CH3COOH的沸点高于HCOOCH3的主要原因是____ 。
(5)已知:氧化镍的晶胞结构如图所示。
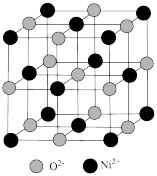
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为______ pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为Ni0.95O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___________ 。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为
(2)C、N、O三种元素中电负性最小的是
(3)Ni(NO3)2中阴离子的空间构型是
(4)一维链状配位聚合物中,碳原子的杂化形式为
(5)已知:氧化镍的晶胞结构如图所示。

①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为
②某缺陷氧化镍的组成为Ni0.95O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为
您最近一年使用:0次
名校
4 . 据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成碳的含氧衍生物。
请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,基态原子核外电子排布要遵循“洪特规则特例”,该原子的外围电子排布式为_________ 。在3d过渡金属中,基态原子未成对电子数最多的元素是_________ (填元素符号)。
(2)石墨烯限域单原子铁能活化CH4分子中C—H键,导致C—H键的键能_________ (填“增大”“减小”或“不变” )。铁晶体中粒子之间作用力类型是_________ 。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_________ 。
②CH4、HCHO的键角较大的是_________ ,主要原因是_________ 。
(4)钴晶胞、白铜(铜镍合金)晶胞如图所示。
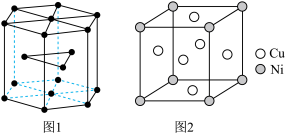
①钴晶胞堆积方式的名称为_________ 。
②已知白铜晶胞的密度为d g·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_________ pm(只列出计算式)。
请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,基态原子核外电子排布要遵循“洪特规则特例”,该原子的外围电子排布式为
(2)石墨烯限域单原子铁能活化CH4分子中C—H键,导致C—H键的键能
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是
②CH4、HCHO的键角较大的是
(4)钴晶胞、白铜(铜镍合金)晶胞如图所示。

①钴晶胞堆积方式的名称为
②已知白铜晶胞的密度为d g·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为
您最近一年使用:0次
2020-12-24更新
|
340次组卷
|
3卷引用:江西省宜春市2021届高三4月模拟考试理科综合化学试题
名校
解题方法
5 . 碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
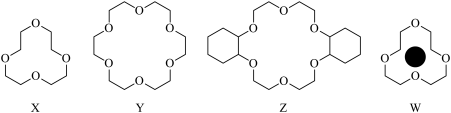
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___ 种运动状态不同的电子,其外围电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
③冠醚分子中氧的杂化轨道的空间构型是___ ,C—O—C的键角___ (填“>”“<”或“=”)109°28′。
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___ 个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加 德罗常数的值为NA,计算石墨晶体的层间距d为___ cm。
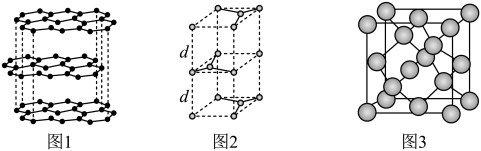
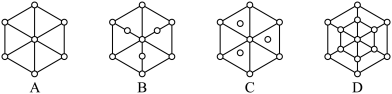
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
③冠醚分子中氧的杂化轨道的空间构型是
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为

(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图

您最近一年使用:0次
2020-06-23更新
|
1027次组卷
|
3卷引用:江西省八所重点中学2020-2021学年高三下学期4月联考理综化学试题



