解题方法
1 . 最近我国科研人员成功攻克了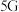 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与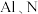 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为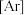
_________ 。
(2)根据元素周期律,元素的电负性
________ (填“大于”或“小于”,下同) ;
;
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于________ 晶体。
(4) 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是_________ , 的沸点比
的沸点比 高的原因是
高的原因是_______ 。
(5) 可采用
可采用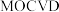 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:____________________________ 。
(6)原子晶体 的晶胞参数
的晶胞参数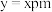 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为_________ ;紧邻的 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的 原子之间的距离为b,则
原子之间的距离为b,则
_________ .该晶胞的密度为__________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为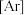
(2)根据元素周期律,元素的电负性

 ;
;(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(4)
 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是 的沸点比
的沸点比 高的原因是
高的原因是(5)
 可采用
可采用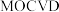 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:(6)原子晶体
 的晶胞参数
的晶胞参数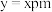 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的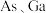 原子之间的距离为b,则
原子之间的距离为b,则
 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。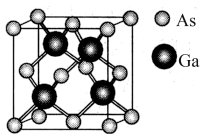
您最近一年使用:0次
名校
2 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:_______ 。
(2)用元素符号表示D所在周期第一电离能最大的元素是_______ ,电负性最大的元素是_______ 。
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区,已知E3+离子比E2+离子稳定,解释其原因_______ E元素原子的核电荷数是_______ ,E元素在周期表中位于第_______ 周期第_______ 族;
(4)已知D氢化物比C的氢化物沸点高,原因是_______ 。

(2)用元素符号表示D所在周期第一电离能最大的元素是
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
(4)已知D氢化物比C的氢化物沸点高,原因是
您最近一年使用:0次
2021-04-12更新
|
84次组卷
|
2卷引用:江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题
名校
3 . 微量元素硼对植物的生长有着十分重要的作用。请回答下列问题:
(1)区分晶体硼和无定硼形科学的方法为_______ 。
(2)B原子基态的价层电子排布图中正确的是_______
A.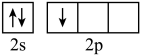 B.
B.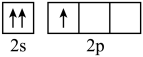 C.
C. D.
D.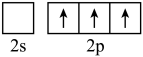
(3)NaBH4是重要的储氢载体,阴离子的立体构型为_______ 。
(1)区分晶体硼和无定硼形科学的方法为
(2)B原子基态的价层电子排布图中正确的是
A.
 B.
B. C.
C. D.
D.
(3)NaBH4是重要的储氢载体,阴离子的立体构型为
您最近一年使用:0次
2021-04-12更新
|
78次组卷
|
2卷引用:江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题
名校
解题方法
4 . (1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
② 的最高能层电子排布式为
的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A. B.
B.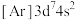 C.
C. D.
D.
(2)二氯甲醛的结构简式为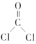 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是___________ 。
(3)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(4)化学上有一种见解,认为含氧酸的通式可以写成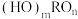 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。
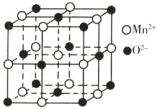
①该晶胞中由 形成的正八面体的空隙数为
形成的正八面体的空隙数为______
②晶胞中距离最近的两个 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为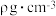 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和 的代数式表示)。
的代数式表示)。

①配合物中每个中心离子的配位数为
②
 的最高能层电子排布式为
的最高能层电子排布式为③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.
 B.
B.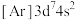 C.
C. D.
D.
(2)二氯甲醛的结构简式为
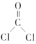 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是(3)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(4)化学上有一种见解,认为含氧酸的通式可以写成
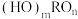 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

①该晶胞中由
 形成的正八面体的空隙数为
形成的正八面体的空隙数为②晶胞中距离最近的两个
 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为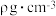 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-04-10更新
|
569次组卷
|
4卷引用:江西省重点中学协作体2021届高三5月第二次联考理综化学试题
名校
5 . 铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+。下列推断正确的是
| A.Tl+的最外层有1个电子 | B.Tl3+的氧化性比Al3+弱 |
| C.Tl+的还原性比Ag强 | D.A、B、C三种说法均不对 |
您最近一年使用:0次
2021-04-09更新
|
141次组卷
|
2卷引用:江西省景德镇一中2020-2021学年高一下学期期中考试化学试题
解题方法
6 . (1)最外层电子数为次外层电子数 的原子
的原子___________ ;(填元素符号,下同)
(2)根据下列微粒回答问题: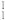 H、
H、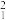 H、
H、 H、
H、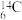 、
、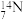 、
、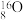 、35Cl2、37Cl2。以上8种微粒共有
、35Cl2、37Cl2。以上8种微粒共有___________ 种核素,互为同位素的___________ ,中子数相等的是___________ 。
(3)写出次氯酸结构式___________ 。
(4)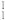 H、
H、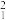 H分别用H、D符号表示,HD则属于
H分别用H、D符号表示,HD则属于___________ (单质、化合物)。
 的原子
的原子(2)根据下列微粒回答问题:
 H、
H、 H、
H、 H、
H、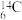 、
、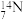 、
、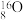 、35Cl2、37Cl2。以上8种微粒共有
、35Cl2、37Cl2。以上8种微粒共有(3)写出次氯酸结构式
(4)
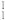 H、
H、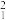 H分别用H、D符号表示,HD则属于
H分别用H、D符号表示,HD则属于
您最近一年使用:0次
解题方法
7 . 中国紫-硅酸铜钡BaCuSi2O6被认为是人工制造的。这种紫色颜料在自然界中还未发现,而秦始皇陵兵马俑是已知的有确切出土地点和年代的最早使用它的实物。
(1)“中国紫”中基态铜离子的价层电子排布式为______ 。其发色中心是以铜离子为中心离子的配位化合物,其中提供孤对电子的是______ 元素。
(2)“埃及蓝”(CaCuSi2O6)是另一种古老的颜料,其合成原料为CaCO3,孔雀绿[Cu2(OH)2CO3]和砂子(SiO2),而中国紫的合成是将CaCO3替换成BaCO3;碳酸根的空间构型为______ 。BaCO3的分解温度大于CaCO3,请从碳酸根稳定性角度说明原因:______ 。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是______ 。
(4)NaCl的晶胞结构如图所示,若将晶胞的面心和体心原子除去,顶点的Na换成U,棱心的Cl换成O,就得到UOx氧化物的晶胞结构。已知立方晶胞参数a=415.6pm,U的相对质量为238,则该氧化物的化学式为______ 。该晶体的密度为______ g/cm3(列出计算表达式,已知阿伏加德罗常数为NA)。

(1)“中国紫”中基态铜离子的价层电子排布式为
(2)“埃及蓝”(CaCuSi2O6)是另一种古老的颜料,其合成原料为CaCO3,孔雀绿[Cu2(OH)2CO3]和砂子(SiO2),而中国紫的合成是将CaCO3替换成BaCO3;碳酸根的空间构型为
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是
(4)NaCl的晶胞结构如图所示,若将晶胞的面心和体心原子除去,顶点的Na换成U,棱心的Cl换成O,就得到UOx氧化物的晶胞结构。已知立方晶胞参数a=415.6pm,U的相对质量为238,则该氧化物的化学式为

您最近一年使用:0次
2021-03-06更新
|
344次组卷
|
2卷引用:江西省南昌市2021届高三下学期3月第一次模拟考试理综化学试题
名校
8 . 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z “组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是(注:实线代表共价键,其他重复单元的 W、X未标注)
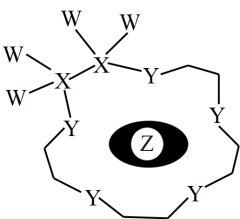

| A.简单气态氢化物的热稳定性:X>Y |
| B.简单离子半径:Y >Z |
| C.W、Y、Z三种元素中组成的二元化合物只有两种离子化合物 |
| D.该化合物中W、X、Y 都满足8电子稳定结构 |
您最近一年使用:0次
2021-03-04更新
|
1626次组卷
|
4卷引用:江西省抚州市黎川县第一中学2020-2021学年高一下学期期末质量检测化学试题
名校
解题方法
9 . 长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是
| A.LiH、LiD、LiT的摩尔质量之比为1:2:3 |
| B.它们都是强氧化剂 |
| C.H、D、T之间互称为同素异形体 |
| D.它们都是强还原剂 |
您最近一年使用:0次
2020-05-11更新
|
110次组卷
|
4卷引用:江西师范大学附属中学2020-2021学年高一下学期4月月考化学试题
解题方法
10 . 2018年7月5日《科学》杂志在线报道:美国研究人员合成一种新的具有超高热导率半导体材料一砷化硼(BAs)。回答下列问题:
(1)基态As原子价层电子的电子排布图(轨道表达式)为_____________ ,基态B原子核外电子占据最高能级的电子云轮廓图为_____________ 。
(2)通过反应4BI3(g)+As4(g)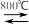 4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。
4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。

①BI3分子空间构型为____________ ,其中B原子杂化方式是____________________ 。
②As4分子中键角为____________ 度,分子中成键电子对与孤电子对数目之比为________________ 。
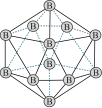
(3)晶态单质硼有多种结构,它们都以B12[结构如图所示]为基本的结构单元。B12结构单元为正_________ 面体。单质硼的熔点为2180℃,它属于_____________ 晶体。

(4)BAs晶胞结构如图所示,已知晶胞参数为0.4777nm,阿伏伽德罗常数的值为NA。As原子的配位数为___________ ;BAs晶体的密度为__________ g·cm-1(列出计算式)。
(1)基态As原子价层电子的电子排布图(轨道表达式)为
(2)通过反应4BI3(g)+As4(g)
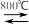 4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。
4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。
①BI3分子空间构型为
②As4分子中键角为

(3)晶态单质硼有多种结构,它们都以B12[结构如图所示]为基本的结构单元。B12结构单元为正

(4)BAs晶胞结构如图所示,已知晶胞参数为0.4777nm,阿伏伽德罗常数的值为NA。As原子的配位数为
您最近一年使用:0次
2019-04-01更新
|
489次组卷
|
2卷引用:江西省丰城中学、高安二中等六校2021届高三1月联考理综化学试题



