2023高一·全国·专题练习
1 . 锡( )是人类较早发现并使用的金属,其原子结构示意图为:
)是人类较早发现并使用的金属,其原子结构示意图为: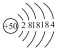 。锡属于主族元素,请描述其在元素周期表中的位置
。锡属于主族元素,请描述其在元素周期表中的位置________ 。有同学认为,锡的金属性比硅强,你认为合理吗?请简述理由。________
 )是人类较早发现并使用的金属,其原子结构示意图为:
)是人类较早发现并使用的金属,其原子结构示意图为: 。锡属于主族元素,请描述其在元素周期表中的位置
。锡属于主族元素,请描述其在元素周期表中的位置
您最近一年使用:0次
2023高三·全国·专题练习
2 . 对角线规则的应用。
(1)[2020·全国卷Ⅲ,35(1)]根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)[2019·全国卷Ⅲ,35(1)]在周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是_______ 。
(1)[2020·全国卷Ⅲ,35(1)]根据对角线规则,B的一些化学性质与元素
(2)[2019·全国卷Ⅲ,35(1)]在周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是
您最近一年使用:0次
3 . 分子筛是一类具有规整孔道结构的多孔材料,能够选择性吸附空间结构各异和不同尺寸的分子,在化学工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:
(1)近期我国科学家制备了一种无缺陷的分子筛膜,可高效分离CH4与CO2两种气体。下列有关分子空间结构的描述正确的是_______
(2)传统的分子筛主要含有O、Na、Al和Si元素,通过调控这 4种元素的比例,可获得不同性能的分子筛产品。这4种元素描述中正确的是_______ 。
(3)通过将分子筛中的元素Na替换为K或Ca,可改变分子筛的孔径大小。这3种元素中说法正确的是_______
(4)N2常用于分子筛的孔结构测试,H、O和N元素可形成多种物质。下列说法正确的是_______
(5)某些分子筛可以选择性吸附Ar。Ar位于元素周期表的_______
| 周期 | 族 | ||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | H | ||||||
| 2 | C | N | O | ||||
| 3 | Na | Al | Si | ||||
| 4 | K | Ca | |||||
| A.CH4是平面结构 | B.CO2是V形结构 |
| C.CH4是正四面体结构 | D.CO2是直线形结构 |
| A.非金属性最强的是O |
| B.核外电子数最少的是 Na |
| C.金属性最强的是Al |
| D.原子半径最大的是Si |
| A.仅Na可与Cl2反应 |
| B.K的单质与水的反应最剧烈 |
| C.Na的氧化物与水的反应均为化合反应 |
| D.Ca的最高价氧化物的水化物碱性最强 |
| A.N2中含有共价三键 |
| B.NO可由NH3催化氧化得到 |
| C.NH3的水溶液呈碱性 |
| D.稀HNO3与Cu反应产生H2 |
| A.第二周期 | B.Ⅷ族 | C.第三周期 | D.0族 |
您最近一年使用:0次
解题方法
4 . 核酸检测是常态化疫情防控的手段之一,核酸采样管中的红色液体是病毒核酸保存液,其成分之一的盐酸胍[结构简式为 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。_____
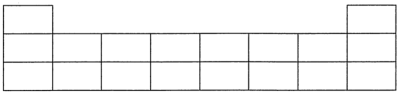
(2)N位于元素周期表的第_______ 周期,第_______ 族。
(3)推测C、N的非金属性强弱:_______ 大于_______ 。
(4)HCl中所含化学键属于_______ ,请用电子式表示HCl的形成过程:_______ 。
 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。

(2)N位于元素周期表的第
(3)推测C、N的非金属性强弱:
(4)HCl中所含化学键属于
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 元素周期表中的数量应用
(1)甲、乙是元素周期表中同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m、n,则m、n的关系为_______ 。
(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是_______ 。
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为_______ 。
(4)下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是_______。
(1)甲、乙是元素周期表中同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m、n,则m、n的关系为
(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为
(4)下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是_______。
A. | B.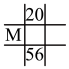 | C.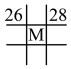 | D.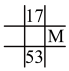 |
您最近一年使用:0次
2023高三·全国·专题练习
6 . 元素周期表中的特殊位置_______

(1)请在上表中画出元素周期表的轮廓,并标出周期序数和族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
(5)标出113号~118号元素的位置。
(6)根据元素原子价电子排布的特征,标出元素周期表分区情况。

(1)请在上表中画出元素周期表的轮廓,并标出周期序数和族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
(5)标出113号~118号元素的位置。
(6)根据元素原子价电子排布的特征,标出元素周期表分区情况。
您最近一年使用:0次
7 . 如图是元素周期表的一部分,回答下列问题。
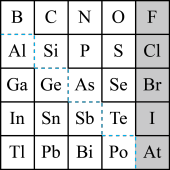
(1)元素 在元素周期表中的位置为
在元素周期表中的位置为_______ (写明周期数和族序数)。
(2) 的最高正价为
的最高正价为_______ , 的最高价氧化物为
的最高价氧化物为_______ (填化学式)。
(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是_______ (填元素符号)。
②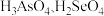 的酸性强弱:
的酸性强弱:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③氢化物的还原性:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
(5)① 常用作溶剂,其电子式为
常用作溶剂,其电子式为_______ 。
②镓( )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是_______ (填序号)。
A.原子半径: B.N的非金属性比O强
B.N的非金属性比O强
C. 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物
(6)用如图装置证明酸性: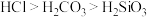 ,则溶液b为
,则溶液b为_______ 。下列事实可用于比较元素C与 非金属性相对强弱的是
非金属性相对强弱的是_______ (填序号)。
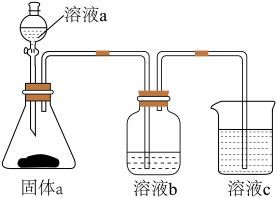
A.最高正化合价
B. 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定
C. 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高
D.最高价氧化物对应的水化物的酸性: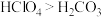

(1)元素
 在元素周期表中的位置为
在元素周期表中的位置为(2)
 的最高正价为
的最高正价为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是
②
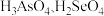 的酸性强弱:
的酸性强弱:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③氢化物的还原性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
| A.农药 | B.合金材料 | C.半导体材料 | D.优良的催化剂 |
 常用作溶剂,其电子式为
常用作溶剂,其电子式为②镓(
 )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是A.原子半径:
 B.N的非金属性比O强
B.N的非金属性比O强C.
 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物(6)用如图装置证明酸性:
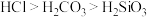 ,则溶液b为
,则溶液b为 非金属性相对强弱的是
非金属性相对强弱的是
A.最高正化合价

B.
 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定C.
 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高D.最高价氧化物对应的水化物的酸性:
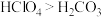
您最近一年使用:0次
名校
8 . A~R 9种元素在元素周期表中的位置如图。
回答下列问题:
(1)E的原子结构示意图为_______ 。
(2)常温下, 的状态为
的状态为_______ (填“液”、“固”或“气”)态。
(3)写出单质A与 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:_______ 。
(4)化合物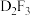 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为_______ 。
(5)H元素形成的单质的用途有_______ (填一种即可)。
(6)最高价氧化物对应水化物的碱性:C_______ (填“>”、“<”或“=”)A,判断的理由为_______ 。
(7)化合物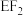 所含分子中的电子总数为
所含分子中的电子总数为_______ ,与其具有相同电子数的化合物分子为_______ (填标号)。
a. b.
b. c.
c. d.
d.
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | A | E | F | |||||
| 3 | C | D | G | H | ||||
| 4 | B | R | ||||||
(1)E的原子结构示意图为
(2)常温下,
 的状态为
的状态为(3)写出单质A与
 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:(4)化合物
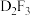 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为(5)H元素形成的单质的用途有
(6)最高价氧化物对应水化物的碱性:C
(7)化合物
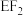 所含分子中的电子总数为
所含分子中的电子总数为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-02-08更新
|
156次组卷
|
3卷引用:河北省保定市定州市第二中学2022-2023学年高一下学期开学考试化学试题
名校
9 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
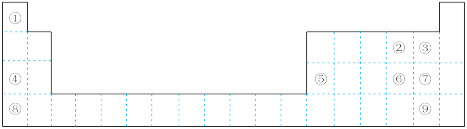
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为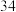
B.气态氢化物的稳定性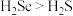
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
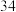
B.气态氢化物的稳定性
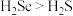
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
名校
解题方法
10 . 一氯化碘(ICl)是一种卤素互化物,与卤素单质性质相似,可用于制农药等。
(1)Cl在元素周期表中位于第三周期、第_______ 族。
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为_______ 价。
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,_______ ,得电子能力Cl强于I。
(4)下列推断中,正确的是_______ (填字母)。
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
(1)Cl在元素周期表中位于第三周期、第
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,
(4)下列推断中,正确的是
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
您最近一年使用:0次
2023-01-17更新
|
273次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题



