22-23高一下·上海浦东新·期中
名校
解题方法
1 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分:
回答下列问题:
(1)As元素在周期表中的位置是:___________ 。
(2)元素①气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(3)元素③、④、⑤的简单离子半径由大到小排序为:___________ (用离子符号表示)。
(4)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能( ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
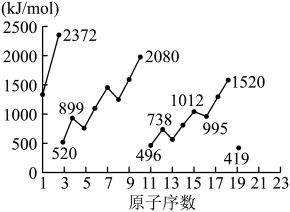
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(6)10号元素Ne的 值较大的原因是
值较大的原因是___________ 。
| ① | ② | ③ | ||
| ④ | P | ⑤ | ⑥ | |
| Ga | Ge | As | Se | Br |
回答下列问题:
(1)As元素在周期表中的位置是:
(2)元素①气态氢化物分子的空间构型是
(3)元素③、④、⑤的简单离子半径由大到小排序为:
(4)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能(
 ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.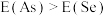 | B. | C. | D. |
 值较大的原因是
值较大的原因是
您最近一年使用:0次
2 . 元素周期表的一部分如图所示,其中每一个序号分别代表一种元素。回答下列问题。

(1)地壳中含量最多的金属元素为___________ (填化学式),该元素在元素周期表中的位置为___________ 。
(2)①和②形成的一种常温下极易溶于水且有刺激性气味的气体的电子式为___________ ,该物质___________ (填“属于”或“不属于”)电解质。
(3)③和④相比较,最简单氢化物的稳定性较强的是___________ (填化学式),简单离子半径:⑤___________ (填“>”、“<”或“=”)⑦。
(4)⑤和⑧相比较,金属性较强的是___________ (填元素符号),下列表述中,能证明这一事实的是___________ (填标号)。
A.⑤单质密度比⑧单质的大
B.⑧单质与水反应比⑤单质与水反应剧烈
C.⑤单质的熔点比⑧单质的高

(1)地壳中含量最多的金属元素为
(2)①和②形成的一种常温下极易溶于水且有刺激性气味的气体的电子式为
(3)③和④相比较,最简单氢化物的稳定性较强的是
(4)⑤和⑧相比较,金属性较强的是
A.⑤单质密度比⑧单质的大
B.⑧单质与水反应比⑤单质与水反应剧烈
C.⑤单质的熔点比⑧单质的高
您最近一年使用:0次
2023-05-15更新
|
194次组卷
|
2卷引用:青海省海东市2022-2023学年高一下学期联考化学试题
名校
3 . 下表显示了元素周期表中的一部分。
请回答下列问题。
(1)硫元素的原子序数是_______ 。
(2)氟元素的原子结构示意图为_______ (填写字母)。
A.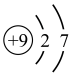 B.
B.
(3)镁元素在元素周期表的第_______ (填“二”或“三”)周期第_______ (填“ⅡA”或“ⅢA”)族。
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H_______ (填“<”或“>”)Na。
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是_______ (填“物理变化”或“化学变化”)。
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为_______ 。
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第一周期 | 1 H 氢 | 2 He 氦 | ||||||
| 第二周期 | 3 Li 锂 | 4 Be 镀 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 第三周期1 | 1 Na 钠 | 12 Mg 镁 | 33 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 C 氯 | 18 Ar 氩 |
(1)硫元素的原子序数是
(2)氟元素的原子结构示意图为
A.
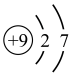 B.
B.
(3)镁元素在元素周期表的第
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为
您最近一年使用:0次
2023-05-11更新
|
205次组卷
|
2卷引用:云南省蒙自市第一高级中学2022-2023学年高一下学期5月期中考试化学试题
名校
4 . 下表是元素周期表的一部分。
(1) 和
和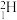 互为
互为___________ ,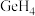 分子的空间结构为
分子的空间结构为___________ 。
(2) 为
为___________ (填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为___________ 。
(3)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________。
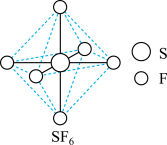
(4) 分子的空间结构为正八面体形,如图所示。
分子的空间结构为正八面体形,如图所示。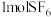 中含有
中含有___________ 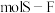 键,它的一氯代物
键,它的一氯代物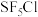 有
有___________ 种。
(5)研究发现,给小鼠喂食适量硒酸钠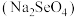 可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | H | ||||||
| 二 | C | O | F | ||||
| 三 | Na | Si | S | Cl | |||
| 四 | Ca | Ge | Se | Br |
 和
和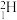 互为
互为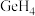 分子的空间结构为
分子的空间结构为(2)
 为
为(3)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________。
A. , , , , 的熔点 的熔点 | B. , , , , 的氧化性 的氧化性 |
C. 、 、 、 、 的热稳定性 的热稳定性 | D. 、 、 、 、 的酸性 的酸性 |
 分子的空间结构为正八面体形,如图所示。
分子的空间结构为正八面体形,如图所示。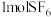 中含有
中含有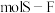 键,它的一氯代物
键,它的一氯代物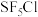 有
有
(5)研究发现,给小鼠喂食适量硒酸钠
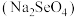 可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
您最近一年使用:0次
5 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
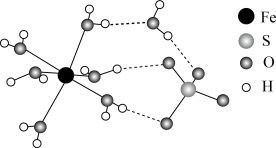
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
204次组卷
|
3卷引用:山西省大同市2022-2023学年高二下学期期中考试化学试题
名校
6 . 元素周期表体现了元素“位-构-性”的关系,下图是元素周期表的一部分,回答下列问题:
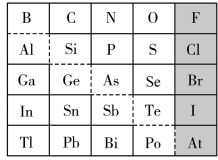
(1)Ga元素的原子结构示意图如图所示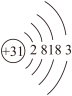 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为___________ 。
(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为___________ ,可作___________ 材料使用;Bi元素的最高价氧化物为___________ (填化学式,下同);I元素的最高价氧化物对应的水化物为___________ 。
(3)以上元素中,失电子能力最强的元素是___________ ,非金属性最强的元素是___________ 。
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是___________ 。
② 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:___________ (用离子符号排序)。
③ 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:___________ 。

(1)Ga元素的原子结构示意图如图所示
 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为
(3)以上元素中,失电子能力最强的元素是
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是
②
 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:③
 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:
您最近一年使用:0次
解题方法
7 . 亚硫酰氯( )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。
(1) 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是_______ 。
(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径_______ ,得电子能力Cl强于S。
②用实验事实验证:将 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是_______ 。
(3)下列关于 的说法正确的是
的说法正确的是_______ (填字母)。
a.属于化合物 b.摩尔质量为119 g·mol
 )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。(1)
 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径
②用实验事实验证:将
 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是(3)下列关于
 的说法正确的是
的说法正确的是a.属于化合物 b.摩尔质量为119 g·mol

您最近一年使用:0次
名校
解题方法
8 . 根据所学知识,回答下列问题:
(1)写出C元素在元素周期表中的位置:___________ ;
(2)写出C与浓硫酸反应的化学方程式:___________ ;
(3)将胆矾晶体投入浓硫酸中,可观察到___________ ,体现了浓硫酸的___________ 性;
(4)除下列气体中的杂质所需要的试剂,括号内为杂质: (HCl)
(HCl)___________ ;NO( )
)___________
(1)写出C元素在元素周期表中的位置:
(2)写出C与浓硫酸反应的化学方程式:
(3)将胆矾晶体投入浓硫酸中,可观察到
(4)除下列气体中的杂质所需要的试剂,括号内为杂质:
 (HCl)
(HCl) )
)
您最近一年使用:0次
9 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的
(2)已知: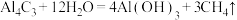 ,写出
,写出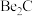 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为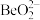 ):
):___________
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
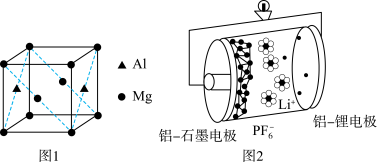
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: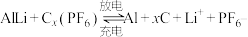 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的
(2)已知:
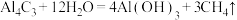 ,写出
,写出 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为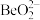 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
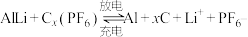 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次
23-24高一上·浙江·期末
解题方法
10 . 回答下列问题:
(1)小苏打的化学式:___________ ,CO2的电子式:___________ 。
(2)请写出红热的铁与水蒸气反应的化学方程式:___________ 。
(3)铯和钠属于同主族元素,铯原子核外有6个电子层,铯在元素周期表中的位置___________ 。
(1)小苏打的化学式:
(2)请写出红热的铁与水蒸气反应的化学方程式:
(3)铯和钠属于同主族元素,铯原子核外有6个电子层,铯在元素周期表中的位置
您最近一年使用:0次



