名校
解题方法
1 . 下图是元素周期表的一部分。
(1)①-⑩元素中最稳定的原子是_______ (填元素符号);形成的气态氢化物稳定性最强的是_______ (填氢化物的化学式)。
(2)②的最高价氧化物的电子式为_______ ;用电子式表示⑤和⑥形成化合物的过程:_______ 。
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为_______ 。
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
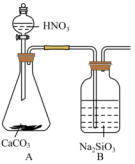
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗_______ (答“合理”或“不合理”),原因是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①-⑩元素中最稳定的原子是
(2)②的最高价氧化物的电子式为
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知
 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗
您最近一年使用:0次
解题方法
2 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
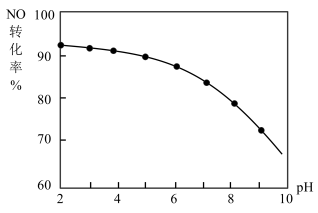
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次
3 . 元素周期表反应了元素存在周期性的变化规律,下表是周期表中部分元素的部分信息:
分析并回答下列问题:
(1)周期表从左到右依次有18个纵行,上述元素在周期表的第______ 个纵行。
(2)上表中xBr、zAt的x=______ ,z=______ 。
(3)yI在周期表中的位置是_______________________ 。
(4)常温下,描述最接近砹单质物理性质的是 。
(5)单质从F2到I2分别与氢气反应的条件依次是 。
(6)下列化学式正确的是 。
(7)IBr是一种拟卤素,它的性质与卤素单质的化学性质相似。请写出Cl2和IBr分别与NaOH溶液反应的化学方程式①____ 、②____ 。其中属于氧化还原反应有____ 。
| 元素名称 | 氟 | 氯 | 溴 | 碘 | 砹 |
| 元素符号 | 9F | 17Cl | xBr | yI | zAt |
| 单质颜色(常态) | 浅黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 | / |
| 单质熔点/℃ | -219.6 | -101 | -7.2 | 113.5 | / |
| 单质沸点/℃ | -188.1 | -34.6 | 58.78 | 184.4 | / |
| 主要化合价 | -1 | -1、+7 | -1、+7 | -1、+7 | / |
分析并回答下列问题:
(1)周期表从左到右依次有18个纵行,上述元素在周期表的第
(2)上表中xBr、zAt的x=
(3)yI在周期表中的位置是
(4)常温下,描述最接近砹单质物理性质的是 。
| A.红色液体易挥发 | B.无色气体易液化 |
| C.灰色固体易升华 | D.黑色固体易升华 |
| A.点燃、接触、加热、强热 | B.强热、接触、加热、点燃 |
| C.接触、点燃、加热、强热 | D.加热、接触、强热、加热 |
| A.Na2At | B.CAt4 | C.AgAt2 | D.At2O7 |
您最近一年使用:0次
4 . 元素在周期表中的位置反映了元素的原子结构和性质,矿物白云母是一种重要的化工原料,其化学式的氧化物形式为:K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1)Al元素在元素周期表中的位置为_____ ,K2O的电子式为_____ 。
(2)上述元素中(Si、H除外),形成的简单离子的半径最小,该离子与过量氨水反应的离子方程式为_____ 。
(3)根据KH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第_____ 族。
(4)某元素R与氧元素同主族,对延长人类寿命起着重要作用,被誉为“生命元素”。已知R元素的原子有4个电子层,则元素R的质子数是_____ 。
(1)Al元素在元素周期表中的位置为
(2)上述元素中(Si、H除外),形成的简单离子的半径最小,该离子与过量氨水反应的离子方程式为
(3)根据KH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第
(4)某元素R与氧元素同主族,对延长人类寿命起着重要作用,被誉为“生命元素”。已知R元素的原子有4个电子层,则元素R的质子数是
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
5 . 元素周期表:_______ 的表格,元素周期系只有一个,元素周期表多种多样。
您最近一年使用:0次
6 . 三张有重要历史意义的周期表
(1)门捷列夫周期表:门捷列夫周期表又称_______ 周期表,重要特征是从第_______ 周期开始每个周期截成_______ 截,第_______ 族分_______ 族,第_______ 族称为过渡元素。
(2)维尔纳周期表
维尔纳周期表是_______ ,每个周期一行,各族元素、过渡金属、稀有气体、镧系和锕系,各有各的位置,同族元素_______ ,它确定了前_______ 个周期的元素种类。
(3)玻尔元素周期表
玻尔元素周期表特别重要之处是把21~28、39~46等元素用_______ 框起,这说明他已经认识到,这些框内元素的原子新增加的_______ 是填入_______ 的,他已经用原子结构解释元素周期系了,玻尔元素周期表确定了第_______ 周期为_______ 种元素。
(1)门捷列夫周期表:门捷列夫周期表又称
(2)维尔纳周期表
维尔纳周期表是
(3)玻尔元素周期表
玻尔元素周期表特别重要之处是把21~28、39~46等元素用
您最近一年使用:0次
21-22高二下·全国·单元测试
7 . 元素周期表的基本结构
(1)周期元素种数的确定
第一周期从_______ 开始,以_______ 结束,只有两种元素。其余各周期总是从_______ 能级开始,以_______ 结束,从ns能级开始以np结束递增的_______ (或电子数)就等于每个周期里的元素数目。
(2)元素周期表的形成
若以一个方格代表一种元素,每个_______ 排一个横排,并按s、p、d、f分段,左侧对齐,可得到如图元素周期表:
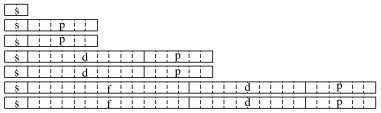
若将p段与p段对齐,d段与d段对齐、f段单独列出,将_______ 与p段末端对齐,则得到书末的元素周期表:
(1)周期元素种数的确定
第一周期从
| 周期 | ns~np | 电子数 | 元素数目 |
| 一 | 1s1~2 | ||
| 二 | 2s1~22p1~6 | ||
| 三 | 3s1~23p1~6 | ||
| 四 | 4s1~23d1~104p1~6 | ||
| 五 | 5s1~24d1~105p1~6 | ||
| 六 | 6s1~24f1~145d1~106p1~6 | ||
| 七 | 7s1~25f1~146d1~107p1~6 |
(2)元素周期表的形成
若以一个方格代表一种元素,每个

若将p段与p段对齐,d段与d段对齐、f段单独列出,将

您最近一年使用:0次
21-22高二下·全国·单元测试
8 . 元素周期表探究
①元素周期表的结构

②元素周期表的分区
i.根据核外电子的排布分区
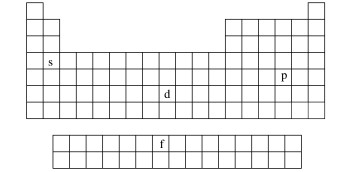
按电子排布式中最后填入电子的_______ 符号可将元素周期表分为s、p、d、f 4个区,而ⅠB、ⅡB族这2个纵行的元素的核外电子因先填满了_______ 能级而后再填充ns能级而得名_______ 区。5个区的位置关系如图所示。
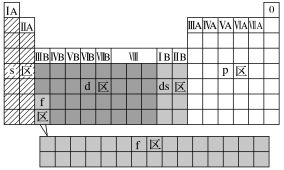
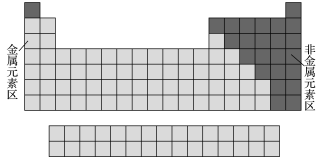
ii.根据元素的金属性和非金属性分区
①元素周期表的结构

②元素周期表的分区
i.根据核外电子的排布分区
按电子排布式中最后填入电子的

ii.根据元素的金属性和非金属性分区

您最近一年使用:0次
名校
解题方法
9 . 填空或写出下列反应的离子方程式:
(1)碘-131是元素碘(元素周期表中第53号元素)的一种放射性同位素,符号为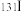 。在核医学中,以
。在核医学中,以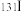 以NaI溶液的形式直接用于甲状腺功能检查和甲状腺疾病。
以NaI溶液的形式直接用于甲状腺功能检查和甲状腺疾病。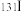 和
和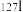 互为同位素,这两种原子的中子数差值为
互为同位素,这两种原子的中子数差值为_________ 。碘元素在元素中位于第__________ 周期第__________ 族。
(2)向明矾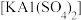 溶液中滴加Ba(OH)2、溶液
溶液中滴加Ba(OH)2、溶液 恰好沉淀,离子方程式是:
恰好沉淀,离子方程式是:________________ 。
(3)实验室常利用氨水制取Al(OH)3,而不用NaOH的溶液的原因是(用离子方程式说明)______ 。
(4)实验室用FeCl2溶液和NaOH溶液制取Fe(OH)2时观察到的现象是________________ 。
(5)将0.2mol钠、镁、铝分别投入10mL1mol/L的盐酸中,在标准状况下产生氢气体积的大小顺序是________________ 。
(1)碘-131是元素碘(元素周期表中第53号元素)的一种放射性同位素,符号为
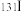 。在核医学中,以
。在核医学中,以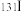 以NaI溶液的形式直接用于甲状腺功能检查和甲状腺疾病。
以NaI溶液的形式直接用于甲状腺功能检查和甲状腺疾病。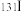 和
和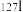 互为同位素,这两种原子的中子数差值为
互为同位素,这两种原子的中子数差值为(2)向明矾
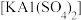 溶液中滴加Ba(OH)2、溶液
溶液中滴加Ba(OH)2、溶液 恰好沉淀,离子方程式是:
恰好沉淀,离子方程式是:(3)实验室常利用氨水制取Al(OH)3,而不用NaOH的溶液的原因是(用离子方程式说明)
(4)实验室用FeCl2溶液和NaOH溶液制取Fe(OH)2时观察到的现象是
(5)将0.2mol钠、镁、铝分别投入10mL1mol/L的盐酸中,在标准状况下产生氢气体积的大小顺序是
您最近一年使用:0次
解题方法
10 . I. 下面是部分元素原子或离子的结构示意图。请你仔细观察、分析,然后回答问题:
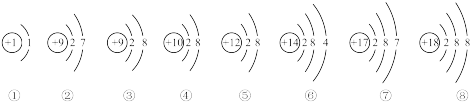
(1)用序号填空:上述粒子中,属于稀有气体元素的原子是_______ ;在化学反应中容易得到电子的是_______ ;属于阳离子的是_______ ;表示F-离子的是_______ ;属于同一种元素的是_______ ;属于非金属元素的是_______ ;电子层数相同,最外层电子数也相同的粒子有_______ ;能与①形成AB4型分子的是_______ 。
II.某微粒的结构示意图可表示为
(2)当x=10+y时,该粒子为_______ (填“原子”、“阳粒子”或“阴离子”),当x<10+y时,该粒子为_______ 。
(3)当y=2时x=_______ 。该元素能形成的离子符号为_______ 。
(4)若该结构示意图表示的粒子是R-,则x=_______ ,y=_______ 。
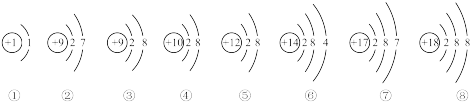
(1)用序号填空:上述粒子中,属于稀有气体元素的原子是
II.某微粒的结构示意图可表示为

(2)当x=10+y时,该粒子为
(3)当y=2时x=
(4)若该结构示意图表示的粒子是R-,则x=
您最近一年使用:0次



