解题方法
1 . 为人们寻找_______ 提供了科学的途径:
(1)在ⅠA族可以找到制造_______ 材料的元素;
(2)在ⅢA、ⅣA、ⅤA族可以找到制造优良的_______ 材料的元素。
(1)在ⅠA族可以找到制造
(2)在ⅢA、ⅣA、ⅤA族可以找到制造优良的
您最近一年使用:0次
解题方法
2 . 已知钛元素是22号元素。
(1)钛元素位于第___________ 周期,有___________ 个电子层。
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为___________ 、___________ 、___________ 。如果前两个电子层排满,可以判断第三层电子___________ (填“排满”或“没排满”)
(1)钛元素位于第
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为
您最近一年使用:0次
名校
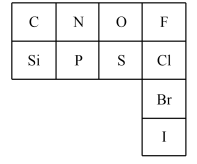
3 . 元素周期表是指导我们系统学习化学的重要工具。下图是元素周期表的一部分。___________ 相同。
(2)氮元素的最低化合价为___________ ,其气态氢化物的电子式为___________ 。在表中所列元素的最高价氧化物对应水化物中酸性最强的是___________ (写化学式)。
(3)Cl的非金属性___________ (填“强于”、“弱于”或“等于”)Br的非金属性。(海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。___________ 。
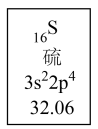
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。___________ (任写一个)。
(2)氮元素的最低化合价为
(3)Cl的非金属性
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。
您最近一年使用:0次
名校
4 . 德米特里·伊万诺维奇·门捷列夫是著名的俄国化学家,他对化学的发展作出了卓越的贡献。请回答下列问题:
(1)门捷列夫的突出贡献是________
(2)某元素的原子L层电子数比K层电子数多3个,与该元素同一主族的短周期元素是___________ 。
(3)C、O、Na的原子半径从大到小的顺序为___________ 。
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。___________ ,周期表中位置:___________ 。
(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是___________ (填元素符号);
②形成化合物种类最多的元素是___________ (填元素符号);
③第三周期中,简单气态氢化物热稳定性最好的是___________ (填写分子式)。
(1)门捷列夫的突出贡献是________
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
(3)C、O、Na的原子半径从大到小的顺序为
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。

(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是
②形成化合物种类最多的元素是
③第三周期中,简单气态氢化物热稳定性最好的是
您最近一年使用:0次
名校
5 . 某种牛奶的营养成分表如下所示(NRV%是指每100g食品中营养素的含量占该营养素每日摄入量的比例)。
回答下列问题。
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是___________ (填元素名称)。
(2)Na在元素周期表中的位置是___________ ,它与氧元素形成的常见化合物中含有非极性共价键,其电子式为___________ 。
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)___________ r(O2-);②沸点:NH3___________ CH4
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 4% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是
(2)Na在元素周期表中的位置是
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| Ca | Mg | |
| 操作 | 取绿豆大小的一块钙投入盛有水的 | 将打磨后的镁条投入盛有冷水的试管中。 |
| 现象 | 钙先沉入水中,表面产生大量气体,一段时间后上浮,溶液变浑浊。 | 一段时间后,镁条表面有细小气泡产生。 |
| 描述或推测 | ①钙密度比水大; ②溶液中产生的沉淀主要是 | 由细小气泡猜测Mg可能与水发生反应,还需要补充的实验操作及现象是 |
| 结论 | 钙能与水反应生成沉淀和氢气,且反应剧烈。 | 镁能与水缓慢反应,化学方程式为 |
您最近一年使用:0次
2023-07-07更新
|
139次组卷
|
2卷引用:四川省成都市2022-2023学年高二下学期期末零诊测试化学试卷
6 . 元素周期律是对元素性质的规律性总结,元素周期表是这种规律的呈现形式。利用元素周期律可以推测一些未知元素可能的性质。根据你所学的周期律,回答下列问题:
(1)元素周期表有几个周期,几个主族。正确选项是
(2)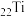 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
(3)元素周期表中,第三电子层有一个未成对电子的元素有___________种(填序号)。
(1)元素周期表有几个周期,几个主族。正确选项是
| A.6,7 | B.7,7 | C.7,18 | D.7,14 |
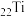 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。| A.1个 | B.2个 | C.3个 | D.5个 |
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
解题方法
7 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),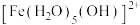 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2) 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
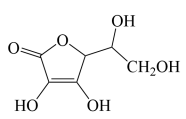
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),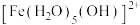 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① | 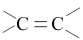 |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
8 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中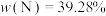 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
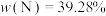 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
解题方法
9 . 铝镁合金是指以镁为主要添加元素的铝合金,在具有较高的强度、耐腐蚀性基础上拥有更低的密度,在电子、汽车、航天等领域有广阔的应用前景。
(1)Al在元素周期表中的位置是第三周期___________ 族。
(2)Al的最高价氧化物对应的水化物的化学式是___________ 。
(3)Al的金属性弱于Mg的,用原子结构解释原因:Al与Mg位于同一周期,原子核外电子层数相同,___________ ,失电子能力Al弱于Mg。
(4)下列实验或事实能说明Mg的金属性强于Al的是___________ (填字母)。
A.碱性: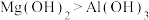
B.密度:Mg<Al
C.Mg能与热水缓慢反应,Al在热水中几乎不反应
(1)Al在元素周期表中的位置是第三周期
(2)Al的最高价氧化物对应的水化物的化学式是
(3)Al的金属性弱于Mg的,用原子结构解释原因:Al与Mg位于同一周期,原子核外电子层数相同,
(4)下列实验或事实能说明Mg的金属性强于Al的是
A.碱性:
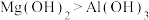
B.密度:Mg<Al
C.Mg能与热水缓慢反应,Al在热水中几乎不反应
您最近一年使用:0次
解题方法
10 . 水泥是人类最伟大的发明之一,主要成分为硅酸三钙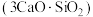 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为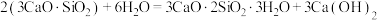 。回答下列问题:
。回答下列问题:
(1)为了加快硅酸三钙与水的反应速率,可采用的方式为_______ (填一种即可)。
(2)Si在元素周期表中的位置为_______ 。
(3) 的电子式为
的电子式为_______ , 的空间结构为
的空间结构为_______ 。
(4)元素C、O、Si、Ca的原子半径由大到小的顺序为_______ 。
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为_______ (用化学方程式表示)。
(6)写出 在农业上的一种用途:
在农业上的一种用途:_______ 。
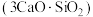 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为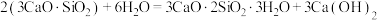 。回答下列问题:
。回答下列问题:(1)为了加快硅酸三钙与水的反应速率,可采用的方式为
(2)Si在元素周期表中的位置为
(3)
 的电子式为
的电子式为 的空间结构为
的空间结构为(4)元素C、O、Si、Ca的原子半径由大到小的顺序为
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为
(6)写出
 在农业上的一种用途:
在农业上的一种用途:
您最近一年使用:0次
2023-06-07更新
|
62次组卷
|
2卷引用:广东省汕头市2022-2023学年高一下学期4月期中考试化学试题



