名校
解题方法
1 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成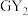 、
、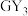 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)X的气态氢化物的电子式为_____ ,工业合成X的气态氢化物的化学方程式为______ 。
(3)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,G的最高价氧化物对应的水化物的浓溶液与金属铜反应的化学方程式为_______ 。
(5)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、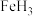
D.比较这两种元素单质与酸或碱反应的难易程度
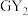 、
、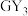 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:(1)Y在元素周期表中的位置为
(2)X的气态氢化物的电子式为
(3)Y、Z、G三种元素原子半径由大到小的顺序是
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为
(5)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、
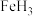
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
名校
解题方法
2 . 下图是元素周期表的一部分,根据①~⑨在周期表中的位置按题目要求回答:
(1)在元素①~⑨中,金属性最强的元素是___________ (填元素符号)。
(2)画出元素④的原子结构示意图___________ 。
(3)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,甲物质的电子式为___________ ,其化学键类型为___________ 共价键(填“极性”或“非极性”)。
(4)元素③⑤对应的最高价氧化物的水化物,它们相互之间能发生反应的离子方程式为___________ 。
(5)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程___________ 。
(6)②与⑥分别形成的氢化物中,稳定性较高的是___________ (填化学式),⑥和⑦的最高价氧化物的水化物酸性___________ 
___________ (填化学式)。
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ | ||||||
(2)画出元素④的原子结构示意图
(3)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,甲物质的电子式为
(4)元素③⑤对应的最高价氧化物的水化物,它们相互之间能发生反应的离子方程式为
(5)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程
(6)②与⑥分别形成的氢化物中,稳定性较高的是

您最近一年使用:0次
2023-04-07更新
|
231次组卷
|
2卷引用:天津市东丽区2021-2022学年高一上学期期末质量检测化学试题
解题方法
3 . 下图是元素周期表的一部分,根据①~⑨在周期表中的位置按题目要求回答:
(1)在元素①~⑨中,金属性最强的元素是______ (填元素符号)。
(2)画出元素④的原子结构示意图______ 。
(3)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的电子式______ ,其化学键类型为______ 共价键(填“极性”或“非极性”)。
(4)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应的离子方程式______ 。
(5)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程______ 。
(6)②与⑥形成两种气态氢化物中,稳定性较高的是______ (填化学式),请从原子结构的角度解释其原因:______ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ | ||||||
(2)画出元素④的原子结构示意图
(3)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的电子式
(4)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应的离子方程式
(5)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程
(6)②与⑥形成两种气态氢化物中,稳定性较高的是
您最近一年使用:0次
名校
解题方法
4 . 下表是元素周期表的一部分,回答下列有关问题:

(1)写出⑥的元素符号:__ ,画出⑫的原子结构示意图__ ;
(2)写出③的单质在空气中燃烧后的产物与二氧化碳反应的化学方程式:__ ;该反应每生成1mol气体转移__ 个电子。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是__ ,碱性最强的是__ ,呈两性的氢氧化物是__ ;
(4)写出单质③在空气中燃烧生成产物的电子式__ ;
(5)用电子式表示出④的氯化物的形成过程___ ;
(6)写出实验室制取⑧的单质的离子方程式___ 。

(1)写出⑥的元素符号:
(2)写出③的单质在空气中燃烧后的产物与二氧化碳反应的化学方程式:
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(4)写出单质③在空气中燃烧生成产物的电子式
(5)用电子式表示出④的氯化物的形成过程
(6)写出实验室制取⑧的单质的离子方程式
您最近一年使用:0次
解题方法
5 . 下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
(1)在元素①~⑨中,金属性最强的元素是__ (填元素符号)。
(2)①、②、③三种元素的原子半径由大到小的顺序是________ (填元素符号)。
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是____ (填化学式)。
(4)元素④的简单氢化物比元素⑧的简单氢化物的稳定性_____ (填“强”或“弱”)。
(5)⑥、⑦、⑨三种元素的常见离子的半径最小的是_______ (用化学式表示)。
(6)元素②和元素④形成的一种化合物在大气中的含量过高时会产生温室效应,写出该化合物的电子式_______ 。
(7)⑤和⑦两种元素的最高价氧化物对应的水化物之间发生反应的离子方程式为____ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)①、②、③三种元素的原子半径由大到小的顺序是
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是
(4)元素④的简单氢化物比元素⑧的简单氢化物的稳定性
(5)⑥、⑦、⑨三种元素的常见离子的半径最小的是
(6)元素②和元素④形成的一种化合物在大气中的含量过高时会产生温室效应,写出该化合物的电子式
(7)⑤和⑦两种元素的最高价氧化物对应的水化物之间发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 下表为元素周期表的一部分,请回答有关问题
(1)已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为______ ;
(2)由元素②和④形成的三核直线型分子的结构式为______ ;
(3)由上述元素构成的淡黄色固体化合物的电子式______ ,该化合物所含的化学键类型_____ (填“离子键”、“极性键”或“非极性键”),若将该固体投入到含有下列离子的溶液中:NO 、 HCO
、 HCO 、CO
、CO 、SO
、SO 、SO
、SO 、Na+反应完毕后,溶液中上述离子数目几乎不变的有
、Na+反应完毕后,溶液中上述离子数目几乎不变的有_____ (用离子符号表示);
(4)元素⑦、⑧、⑨其离子半径由大到小的顺序是_________ ,元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为__________ ;
(5)下列事实不能说明元素⑧的非金属性比元素⑦的非金属性强的是____ ;
A 元素⑧的单质与⑦的氢化物的水溶液反应,溶液变浑浊
B 元素⑧的单质能将Fe氧化成三价铁,而元素⑦的单质只能将铁氧化成二价铁
C ⑦和⑧两元素的简单氢化物受热分解,后者的分解温度高
D 元素⑧的氢化物的水溶液的酸性比元素⑦的氢化物水溶液的酸性强
(6)由上表中的元素构成的A+、B+、C-、D、E五种10电子粒子,已知他们有如下转化关系:A++C- D+E↑;B++C-=2D;写出A+、B+的化学式
D+E↑;B++C-=2D;写出A+、B+的化学式________ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为
(2)由元素②和④形成的三核直线型分子的结构式为
(3)由上述元素构成的淡黄色固体化合物的电子式
 、 HCO
、 HCO 、CO
、CO 、SO
、SO 、SO
、SO 、Na+反应完毕后,溶液中上述离子数目几乎不变的有
、Na+反应完毕后,溶液中上述离子数目几乎不变的有(4)元素⑦、⑧、⑨其离子半径由大到小的顺序是
(5)下列事实不能说明元素⑧的非金属性比元素⑦的非金属性强的是
A 元素⑧的单质与⑦的氢化物的水溶液反应,溶液变浑浊
B 元素⑧的单质能将Fe氧化成三价铁,而元素⑦的单质只能将铁氧化成二价铁
C ⑦和⑧两元素的简单氢化物受热分解,后者的分解温度高
D 元素⑧的氢化物的水溶液的酸性比元素⑦的氢化物水溶液的酸性强
(6)由上表中的元素构成的A+、B+、C-、D、E五种10电子粒子,已知他们有如下转化关系:A++C-
 D+E↑;B++C-=2D;写出A+、B+的化学式
D+E↑;B++C-=2D;写出A+、B+的化学式
您最近一年使用:0次
2020-08-22更新
|
411次组卷
|
2卷引用:天津市第一中学2019-2020学年高一上学期期末考试化学试题2
7 . X、Y、Z、W、R、M、N是7种短周期元素,原子序数依次增大。已知X组成的单质是密度最小的气体,Y是形成化合物种类最多的元素,W原子最外层电子数是次外层电子数的3倍,R、M、N处于同一周期,R是该周期中金属性最强的元素,R与N能形成化合物RN,M与W同一主族。
请回答下列问题:
(1)Z在周期表中的位置是________________ ;N的原子结构示意图是____________ 。
(2)X、Y形成含碳量最小的有机物分子的空间构型是_____________ 。
(3)X、W、N按照原子个数比1∶1∶1形成的化合物的电子式为_____________ 。
(4)W与R形成的化合物R2W2可作供氧剂,该化合物含有的化学键类型有:_________ ,该化合物与YW2反应的化学方程式是__________________________________________________________ 。
(5)在一定条件下,往M的氢化物的水溶液中通入N的单质,出现浑浊,则该反应的化学方程式是_________ 。此反应可证明单质氧化性M___________ N(填“>”、“<”或“=”)。
(6)以上几种元素任意组合,可形成的酸性最强的物质是________________________ ,可形成的碱性最强的物质是_______________________ (填写化学式)
请回答下列问题:
(1)Z在周期表中的位置是
(2)X、Y形成含碳量最小的有机物分子的空间构型是
(3)X、W、N按照原子个数比1∶1∶1形成的化合物的电子式为
(4)W与R形成的化合物R2W2可作供氧剂,该化合物含有的化学键类型有:
(5)在一定条件下,往M的氢化物的水溶液中通入N的单质,出现浑浊,则该反应的化学方程式是
(6)以上几种元素任意组合,可形成的酸性最强的物质是
您最近一年使用:0次
解题方法
8 . 饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
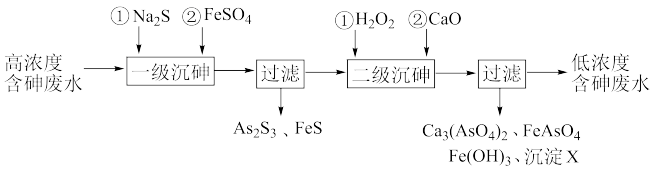
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2
2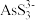 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________ ;AsH3的电子式为____________ ;
(2)根据元素周期律,下列说法正确的是_________ 。
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________ 。
(4)沉淀X为_________________ (填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________ 。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2
2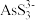 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为
(4)沉淀X为
(5)“一级沉砷”中FeSO4的作用是
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中(0.65)
|
真题
名校
9 . 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为______________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________ 。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____ ,
N→⑥的单质的化学方程式为_____ 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
N→⑥的单质的化学方程式为
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
您最近一年使用:0次
2016-12-09更新
|
79次组卷
|
5卷引用:2009年普通高等学校招生统一考试理综试题化学部分(天津卷)
2009年普通高等学校招生统一考试理综试题化学部分(天津卷)2009高考真题汇编-无机综合题(已下线)2011届上海市吴淞中学高三上学期期中考试化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷黑龙江省大庆中学2016-2017学年高一下学期期末考试化学试题



