1 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,a、b、c、d、e、f是这些元素组成的化合物,其转化关系如图所示,0.01mol/La溶液的pH=12,且焰色反应呈黄色,b是形成酸雨的主要成分,e是二元化合物,且0.01mol/Le溶液的pH=2,下列说法正确的是
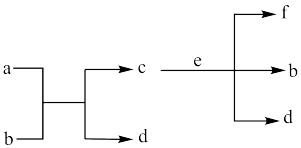
| A.原子半径:Q>W>Z>Y>X | B.简单氢化物的稳定性:Q>W |
| C.a、e、f均能抑制水的电离 | D.a、b、c、d、e、f均含有极性共价键 |
您最近一年使用:0次
2 . 已知W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Z位于同一主族,X、Y位于同一周期,W元素原子的核外电子数与其周期序数相等,X的常见单质液态时是淡蓝色,常温下,Y的常见单质是一种有颜色的气体。下列有关说法正确的是
A.简单离子半径: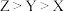 |
B.最简单氢化物的熔、沸点: |
| C.Y的最高价氧化物对应的水化物为强酸 |
| D.由W、X、Z形成的三元化合物只含有离子键 |
您最近一年使用:0次
2024-03-31更新
|
156次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
3 . 一种由短周期主族元素组成的抗病毒化合物的结构如图,其中Q、W、X、Y、Z的原子序数依次增大,Q为元素周期表中原子半径最小的元素,Y原子最外层电子数是Z原子电子层数的3倍。下列说法正确的是


| A.简单氢化物的沸点:Z<Y | B.基态原子未成对电子数:Z>W |
| C.简单离子半径:Y<Z | D.基态原子第一电离能由大到小的顺序为:Z>Y>X>W |
您最近一年使用:0次
4 . X、Y、Z、W、M为原子序数依次增大的前四周期元素,5种元素组成的化合物M(YX3)4WZ常用作杀虫剂。其中Y的基态原子2p轨道半充满,Z为地壳中含量最高的元素,Z的核外电子数等于X、Y核外电子数之和,W和Z同族,M元素基态原子的内层电子全充满、最外层只有1个电子。下列说法错误的是
| A.原子半径:W>Y>Z |
| B.简单氢化物的稳定性:Y>Z |
| C.M元素位于周期表的ds区 |
D.YX3和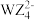 的中心原子杂化方式相同 的中心原子杂化方式相同 |
您最近一年使用:0次
名校
5 . 短周期主族元素V、W、X、Y、Z的原子序数依次增大。基态V原子核外3个能级上电子数相等,基态X原子核外s能级、p能级上电子总数相等。0.2molZ与足量的稀硫酸反应产生 (标准状况)。Y的部分电离能数据如下:
(标准状况)。Y的部分电离能数据如下:
下列叙述错误的是
 (标准状况)。Y的部分电离能数据如下:
(标准状况)。Y的部分电离能数据如下:| 电离能 |  |  |  |  |
( ) ) | 738 | 1451 | 7733 | 10540 |
| A.原子半径:Y>Z>V | B.第一电离能:V<W<X |
| C.简单氢化物的稳定性:V<W<X | D.最高价氧化物对应水化物的碱性:Z<Y |
您最近一年使用:0次
名校
6 .  是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与
是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与 元素组成的化合物M[化学式:
元素组成的化合物M[化学式: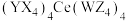 ]是分析化学常用的滴定剂。下列说法错误的是
]是分析化学常用的滴定剂。下列说法错误的是
 是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与
是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与 元素组成的化合物M[化学式:
元素组成的化合物M[化学式: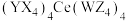 ]是分析化学常用的滴定剂。下列说法错误的是
]是分析化学常用的滴定剂。下列说法错误的是A.化合物M中 的化合价为 的化合价为 |
B.简单离子半径: |
C.与X形成的简单化合物的沸点: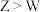 |
D.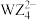 的空间结构为正四面体 的空间结构为正四面体 |
您最近一年使用:0次
真题
解题方法
7 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: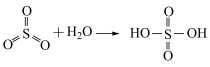
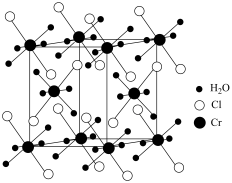
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: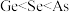 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
名校
解题方法
8 . 前四周期元素A、B、C、D、E、F、G、H的原子序数依次增大,在元素周期表中A的原子半径最小,B与C相邻且C的最外层电子数是次外层的3倍,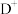 与
与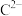 具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
(1)C在元素周期表中的位置为___________ , 的离子结构示意图
的离子结构示意图___________ 。
(2)C和D也可形成一种漂白性物质,其电子式为___________ ,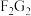 是
是___________ 键(填“极性键”或“非极性键”)构成的___________ 分子(填“极性”或“非极性”)。
(3)比较C和F简单氢化物的键角大小:___________ (用化学式表示),F和G的最高价氧化物的水化物酸性较强的是___________ (用化学式表示)。
(4)比较C、D、E三者离子半径的大小:___________ (用离子符号表示)。
(5)下列叙述正确且能用于比较元素D和E金属性强弱的是___________(填序号)。
(6)过量的 与G的单质的反应方程式:
与G的单质的反应方程式:___________ 。
(7)H的氢氧化物可溶于B的简单氢化物对应的水溶液反应,其离子方程式为___________ 。
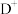 与
与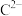 具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:(1)C在元素周期表中的位置为
 的离子结构示意图
的离子结构示意图(2)C和D也可形成一种漂白性物质,其电子式为
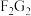 是
是(3)比较C和F简单氢化物的键角大小:
(4)比较C、D、E三者离子半径的大小:
(5)下列叙述正确且能用于比较元素D和E金属性强弱的是___________(填序号)。
| A.在化合物中E的化合价比D的高 |
| B.E的单质不能与冷水反应而D的单质能 |
| C.E的最高价氧化物对应水化物的碱性比D弱 |
| D.D的单质无法从E的盐溶液中置换出E |
 与G的单质的反应方程式:
与G的单质的反应方程式:(7)H的氢氧化物可溶于B的简单氢化物对应的水溶液反应,其离子方程式为
您最近一年使用:0次
名校
9 . A、B、C、D、E五种原子序数均小于18的元素,且原子序数依次增大,其中B与C的电子层数相同,D与E的电子层数相同,A与D的最外层电子数相同,C与E的最外层电子数相同,E元素的原子最外层电子数是电子层数的2倍,D与其他具有相同电子层数的原子相比半径最大。又知由B元素组成的单质是空气中的主要成分。
(1)B的元素名称是_______ ,该元素的原子结构示意图为_______ ,核外有___ 个未成对电子,用电子式表示B的简单氢化物的形成过程_________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)_____ 。
(4)以下说法正确的是________ 。
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
(1)B的元素名称是
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)
(4)以下说法正确的是
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
您最近一年使用:0次
2024-01-21更新
|
133次组卷
|
2卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高三上学期第三次月考化学试卷
10 . 硫、氮的化合物及其相互转化在促进社会进步、资源利用和环境保护中具有重要价值。
(1)下列与氮氧化物无关的环境问题是______。
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液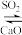 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是___________ 。(用化学方程式表示)
(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是___________ 。
②上述反应中的各物质属于共价化合物是______ ;氧化剂是_______ 。
③配平上述反应方程式,并标出电子转移的方向和数目______ 。
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:________ 。
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c( )最大的是______。
)最大的是______。
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式___________ 。
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是________ 。
(1)下列与氮氧化物无关的环境问题是______。
| A.酸雨 | B.白色污染 | C.光化学烟雾 | D.温室效应 |
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液
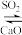 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是
②上述反应中的各物质属于共价化合物是
③配平上述反应方程式,并标出电子转移的方向和数目
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c(
 )最大的是______。
)最大的是______。| A.氨水 | B.NH4Cl | C.NH4HCO3 | D.NH4HSO4 |
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是
您最近一年使用:0次



