1 . 几种短周期元素的原子半径及主要化合价见下表,下列相关叙述错误的是
| 元素代号 |  |  |  |  | 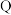 |
原子半径 |  |  | 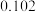 | 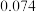 |  |
| 主要化合价 |  |  |  、 、 |  |  、 、 |
A. 、 、 最高价氧化物对应的水化物碱性: 最高价氧化物对应的水化物碱性: |
B.离子半径: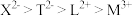 |
C. 单质能与 单质能与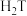 反应,置换出 反应,置换出 |
D. 的最高价氧化物是两性氧化物 的最高价氧化物是两性氧化物 |
您最近一年使用:0次
解题方法
2 . 2022年诺贝尔化学奖授予了点击化学等领域。我国科学家在研究点击反应砌块的过程中,发现了一种结构如图的化合物,X、Y、Z和W是原子序数依次增大的短周期元素,Y和W是同主族元素。下列说法正确的是


| A.简单离子半径:Y<Z |
| B.简单氢化物的沸点:Y<W |
| C.化合物XH4H中的化学键均为共价键 |
| D.Y与X、Y与W均能形成多种化合物 |
您最近一年使用:0次
名校
3 . 已知R、W、X、Y、Z均为短周期主族元素,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质形成的合金可用作原子反应堆导热剂,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,下列叙述中错误的是
A.R、X、Y对应的简单离子半径: |
| B.相同温度下,同浓度的R、W、Z的最高价含氧酸的酸性:R>W>Z |
C.将 与 与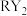 分别通入 分别通入 溶液中,现象不同 溶液中,现象不同 |
| D.因为Y的氢化物比R的氢化物稳定,所以Y的氢化物的熔、沸点比R的氢化物的熔、沸点高 |
您最近一年使用:0次
2023-02-16更新
|
1254次组卷
|
7卷引用:山西省怀仁市第一中学校北校区2022届高三高考预测猜题卷理科综合化学试题
2022·浙江·模拟预测
名校
4 . 短周期元素W、X、Z、Y、N原子序数依次增大,W与Y原子最外层电子数之和等于X原子最外层电子数,五种元素能组成如图所示物质,下列说法正确的是


A.原子半径: |
B.含氧酸酸性: |
| C.Z、N都能与X形成有漂白性的物质,且漂白原理相似 |
D.该化合物中所有原子都满足最外层 结构 结构 |
您最近一年使用:0次
5 . 五种前四周期的元素X、Y、Z、Q、W的原子序数依次增大。基态X原子的电子层数、能级数目和轨道数目均相等,Y与X可形成 、
、 两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为
两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为 ,下列有关说法错误的是
,下列有关说法错误的是
 、
、 两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为
两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为 ,下列有关说法错误的是
,下列有关说法错误的是| A.Y、Z、Q三种元素的电负性大小关系为Q>Z>Y |
| B.X、Y、W三种元素形成的某化合物,可存在于碱性电池中 |
| C.最高价氧化物对应水化物的酸性:Q>Z |
| D.元素对应的离子半径大小关系为Z>Q>Y>X |
您最近一年使用:0次
2022-12-28更新
|
828次组卷
|
2卷引用:广东省汕头市普通高中2022-2023学年高三上学期教学质量检测化学试题
解题方法
6 . 某离子液体的部分结构如图。短周期主族元素V、W、X、Y、Z的原子序数依次增大,但V、W、X、Y的原子半径依次减小,V、W位于相邻的主族,X、Z同主族,且Z的原子序数为X的2倍。下列说法正确的是


| A.V位于元素周期表第二周期第IVA族 | B.简单离子半径:Z>Y>X |
| C.氢化物的熔沸点大小顺序一定为V<W<X | D.该离子液体中X、Y、V、W均达到 稳定结构 稳定结构 |
您最近一年使用:0次
名校
7 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
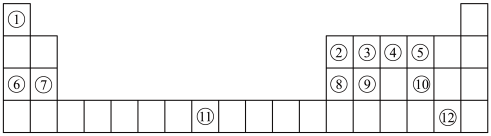
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
338次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
名校
8 . W、X、Y、Z是原子序数依次增大的短周期主族元素,W且原子序数总和为25,由这四种元素形成的某化合物结构如图所示,下列叙述正确的是
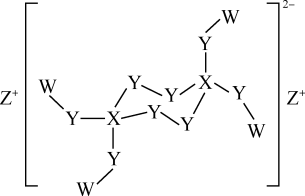

| A.简单离子半径:Y<Z |
| B.该化合物中X、Y的杂化方式相同 |
| C.该化合物的阴离子中各原子最外层均达到8电子稳定结构 |
| D.W分别与X、Y、Z形成的晶体类型相同 |
您最近一年使用:0次
名校
解题方法
9 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
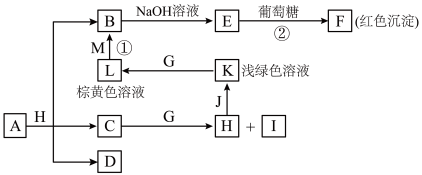
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
344次组卷
|
5卷引用:黑龙江省哈尔滨市第三中学校2022-2023学年高三上学期第一次验收考试化学试题
10 . 钠元素和氯元素是两种重要的短周期元素,按要求完成问题。
(1)下列说法错误的是___________。
(2)常温下氯化钠晶体是绝缘体,温度升高导电性增强,导电的原因是钠离子迁移到空位(截取了晶胞的 ,如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm,
,如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm, ,
, 。
。

在氯化钠晶胞中,与钠离子配位的氯离子形成的空间构型是___________ 。钠离子迁移时垂直穿过A、B、C3个氯离子形成的孔O,其平面位置关系如上图,孔O的半径为___________ pm(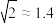 ,
,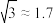 ,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因
,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因___________ 。
(3)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为 ,则B、C的原子坐标参数分别为
,则B、C的原子坐标参数分别为___________ 、___________ 。该晶胞中Cd-Se键的键长为___________ 。已知Cd和Se的原子半径分别为b nm和c nm,则该晶胞中原子的体积占晶胞体积的百分率为___________ 。

(1)下列说法错误的是___________。
| A.基态氯原子未成对电子数与基态钠原子的相同 |
| B.第三周期元素中氯元素的第一电离能最大 |
| C.短周期主族元素简单离子中钠离子的半径最大 |
| D.氯化钠的熔点高于溴化钠的熔点 |
 ,如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm,
,如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm, ,
, 。
。
在氯化钠晶胞中,与钠离子配位的氯离子形成的空间构型是
 ,
,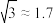 ,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因
,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因(3)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为
 ,则B、C的原子坐标参数分别为
,则B、C的原子坐标参数分别为
您最近一年使用:0次



