名校
解题方法
1 . 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21.下列关系正确的是
| W | X | |||
| Y | Z |
| A.第一电离能:W<X |
| B.工业上通过电解熔融的化合物Y2X3来制取Y单质 |
| C.简单离子的半径:Y>X |
| D.最高价氧化物对应水化物的酸性:Y>Z |
您最近一年使用:0次
2 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 最高价 氧化物的水化物 | X | Y | Z | W |
| 分子式 | 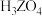 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.含氧酸酸性强弱:Z<W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
3 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子的最外层有4个电子,W原子在同周期中原子半径最大。下列说法错误的是
| A.第一电离能:Y>Z>X |
| B.电负性:Z>Y>X>W |
| C.Z、W原子形成稀有气体电子构型的简单离子的半径:W< Z |
| D.W2X2与水反应生成产物之一是非极性分子 |
您最近一年使用:0次
名校
4 . 下列比较正确的是
| A.第一电离能:F>O>N | B.离子半径:Na+>Al3+>F- |
| C.分子内键角:BeCl2>SO3>NH3>CCl4 | D.稳定性:HCl>HBr>HI |
您最近一年使用:0次
名校
5 . 下列比较正确的是
| A.离子半径:S2->Cl->K+ | B.键角:CH4<NH3<H2O |
| C.热稳定性:NH3>PH3>HF | D.酸性:HNO3<H3PO4<H2SiO3 |
您最近一年使用:0次
2024-04-15更新
|
310次组卷
|
2卷引用:天津市第一中学2023-2024学年高三下学期5月月考化学试卷
名校
解题方法
6 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成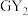 、
、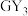 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)X的气态氢化物的电子式为_____ ,工业合成X的气态氢化物的化学方程式为______ 。
(3)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,G的最高价氧化物对应的水化物的浓溶液与金属铜反应的化学方程式为_______ 。
(5)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、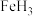
D.比较这两种元素单质与酸或碱反应的难易程度
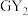 、
、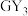 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:(1)Y在元素周期表中的位置为
(2)X的气态氢化物的电子式为
(3)Y、Z、G三种元素原子半径由大到小的顺序是
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为
(5)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、
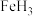
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
名校
7 . 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
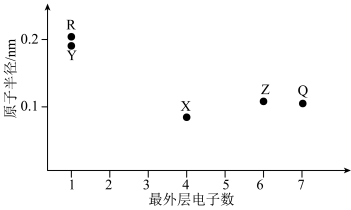

| A.X的电负性比Q的大 |
| B.R和Q形成的化合物固态时为分子晶体 |
| C.Z的简单离子半径比R的大 |
| D.Z的简单气态氢化物的热稳定性比Q的强 |
您最近一年使用:0次
名校
解题方法
8 . 汽车发动机代用燃料包括乙醇、氢气和甲烷等。回答下列问题:
(1)在25℃、 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量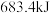 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为___________ 。
(2)根据图甲中的能量关系,可求得 键的键能为
键的键能为___________  。
。

(3)甲烷完全燃烧反应的能量关系如图乙所示。

①

___________ (用含 和
和 的关系式表示)。
的关系式表示)。
②为提高燃料利用率,加入甲烷燃烧的催化剂,则
___________ (填“变大”、“变小”或“不变”,下同),该反应的
___________ 。
(4)已知氢气的燃烧热为 ,甲烷的燃烧热为
,甲烷的燃烧热为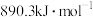 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:___________ 。
(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:___________ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________ ,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(1)在25℃、
 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量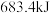 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为(2)根据图甲中的能量关系,可求得
 键的键能为
键的键能为 。
。
(3)甲烷完全燃烧反应的能量关系如图乙所示。

①


 和
和 的关系式表示)。
的关系式表示)。②为提高燃料利用率,加入甲烷燃烧的催化剂,则


(4)已知氢气的燃烧热为
 ,甲烷的燃烧热为
,甲烷的燃烧热为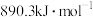 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
您最近一年使用:0次
名校
9 . A、B、D、E、M、X、Y、Z是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;B的基态原子次外层有2个电子,最外层有3个未成对电子;D原子的2p轨道上有1个电子的自旋方向与其它电子相反;E的价层电子排布式为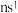 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)___________ 。
(2)元素B基态原子的核外电子排布式为___________ ,电子的空间运动状态有___________ 种,它与同周期相邻的两种元素中的第一电离由大到小的顺序是___________ (写元素符号)。
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为___________ ;
②D的配位数是___________ ;
③D周围最近的D有___________ 个;
④距离Z最近D的为___________ 个;
⑤此晶体的密度为___________  ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)
⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为___________ , 该离子含有
该离子含有___________ mol 键,其中配位体为
键,其中配位体为___________ 分子(填“极性”或“非极性”),空间构型为___________ ;
(4)基态M原子电子占据最高能级的电子云轮廓图为___________ 形,将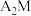 通入
通入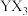 溶液中反应的离子方程式为
溶液中反应的离子方程式为___________ ;
(5)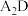 分子中
分子中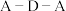 键角比
键角比 中
中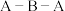 键角
键角___________ ;(填“大”或“小”)
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为___________ , 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为___________  ,含有
,含有___________ 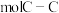 键。
键。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___________ 个六元环,六元环中最多有___________ 个C原子在同一平面。
(7) 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为___________ ,晶体中 原子与
原子与 键的数目之比为
键的数目之比为___________ 。
 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)
(2)元素B基态原子的核外电子排布式为
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②D的配位数是
③D周围最近的D有
④距离Z最近D的为
⑤此晶体的密度为
 ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为
 该离子含有
该离子含有 键,其中配位体为
键,其中配位体为(4)基态M原子电子占据最高能级的电子云轮廓图为
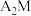 通入
通入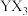 溶液中反应的离子方程式为
溶液中反应的离子方程式为(5)
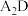 分子中
分子中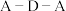 键角比
键角比 中
中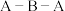 键角
键角(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为
 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为 ,含有
,含有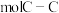 键。
键。②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
(7)
 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为 原子与
原子与 键的数目之比为
键的数目之比为
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D是原子序数依次增大的前四周期元素,A元素原子最高能级的不同轨道都有电子且自旋方向相同;B元素原子的价层电子排布式是 ;其中C元素的部分电离能如下表;D元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法不正确的是
;其中C元素的部分电离能如下表;D元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法不正确的是( )
 ;其中C元素的部分电离能如下表;D元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法不正确的是
;其中C元素的部分电离能如下表;D元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法不正确的是| 元素 | 电离能( ) ) | |||
 |  |  |  | |
| C | 578 | 1817 | 2745 | 11575 |
| A.离子半径大小:A>B |
| B.C单质可通过电解C的氯化物制备 |
| C.简单氢化物的稳定性:A<B |
| D.元素D的核外电子运动具有15种不同的空间运动状态 |
您最近一年使用:0次
2023-12-14更新
|
274次组卷
|
2卷引用:天津市第一中学2023-2024学年高三上学期第二次月考化学试题



