名校
1 . 某同学在图书馆查阅砷(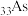 )、镓(
)、镓( )、锗(
)、锗(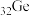 )、硅(
)、硅( )四个元素的原子半径数值,但仓促之间只在笔记本上写下了“118pm、120pm、122pm、135pm”这四个数值,忘了标注数值与元素的对应关系。请根据元素周期表的知识推断“锗(
)四个元素的原子半径数值,但仓促之间只在笔记本上写下了“118pm、120pm、122pm、135pm”这四个数值,忘了标注数值与元素的对应关系。请根据元素周期表的知识推断“锗(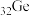 )”的数值最有可能是
)”的数值最有可能是
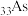 )、镓(
)、镓( )、锗(
)、锗(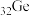 )、硅(
)、硅( )四个元素的原子半径数值,但仓促之间只在笔记本上写下了“118pm、120pm、122pm、135pm”这四个数值,忘了标注数值与元素的对应关系。请根据元素周期表的知识推断“锗(
)四个元素的原子半径数值,但仓促之间只在笔记本上写下了“118pm、120pm、122pm、135pm”这四个数值,忘了标注数值与元素的对应关系。请根据元素周期表的知识推断“锗(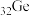 )”的数值最有可能是
)”的数值最有可能是| A.135pm | B.122pm | C.120pm | D.118pm |
您最近一年使用:0次
名校
2 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
338次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
名校
3 . 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为_______ ;写出M原子核外能量最高的电子的电子排布式为_______ ;
(2)常温下,不能与R单质发生反应的是_______ (选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_______ 。
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为_______ 。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:_______ 。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:_______ 。
_______SiO2+_______C+_______N2 _______Si3N4+_______CO
_______Si3N4+_______CO
(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_______ 。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为
(2)常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
_______SiO2+_______C+_______N2
 _______Si3N4+_______CO
_______Si3N4+_______CO(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为
您最近一年使用:0次
名校
解题方法
4 . W、X、Y、Z是原子序数依次增大的四种短周期元素,只有X、Y位于同一周期,且Y与Z位于同一主族,四种元素可形成一种在医疗农业、染料上有广泛用途的物质,其物质结构如图所示。下列叙述正确的是
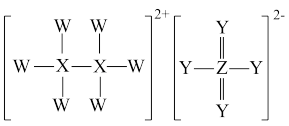

| A.原子半径:Z>Y>X>W |
| B.等物质的量浓度的X和Z的含氧酸的酸性:Z>X |
| C.W、X、Z均可与Y形成多种化合物 |
| D.简单氢化物的还原性:Y>Z |
您最近一年使用:0次
2022-04-01更新
|
1185次组卷
|
5卷引用:重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题
重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(河北专用)(已下线)秘籍09 位、构、性的关系-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)河南省济源高级中学2022-2023学年高二下学期4月月考 化学试卷
解题方法
5 . X、Y、Z、W是原子序数依次增大的短周期元素,X与W同主族,且W原子核内质子数是X原子核外电子数的两倍,Y是同周期元素中原子半径最大的,Y、Z、W的最高价氧化物对应的水化物可两两反应生成盐和水,甲是Z、W两种元素形成的化合物。下列说法错误的是
| A.X单质的氧化性强于W单质 |
| B.Z的合金在生产生活中用途广泛 |
| C.可以在水溶液中利用复分解反应制备甲 |
| D.离子半径:W>X>Y>Z |
您最近一年使用:0次
2022高三·全国·专题练习
6 . 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为_______ ;
(2)常温下,不能与R单质发生反应的是_______(选填序号);
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_______ 。
(4)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为_______ 。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:_______ 。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:_______ 。
_______SiO2+_______C+_______N2 _______Si3N4+_______CO
_______Si3N4+_______CO
(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_______ 。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为
(2)常温下,不能与R单质发生反应的是_______(选填序号);
| A.CuCl2溶液 | B.Fe2O3 | C.浓硫酸 | D.Na2CO3溶液 |
(4)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
_______SiO2+_______C+_______N2
 _______Si3N4+_______CO
_______Si3N4+_______CO(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为
您最近一年使用:0次
名校
解题方法
7 . 卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
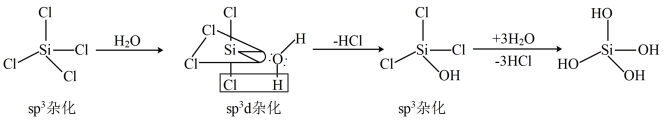
CCl4不能按照上述机理发生水解反应,原因是___________ 。
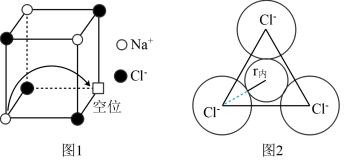
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |

 。
。 离子的空间构型为
离子的空间构型为(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确
 ≈1.414,
≈1.414, ≈1.732)
≈1.732)
您最近一年使用:0次



