名校
1 . X、Y、Z、W是原子序数依次增大的位于两个短周期主族元素,Y、W原子核外未成对电子数相同,Z与X的简单化合物很容易液化,X、Z核外最外层电子数之和等于W核外最外层电子数。四种元素能组成一种治疗痛风症的药物M,M的结构简式如图所示。下列说法正确的是
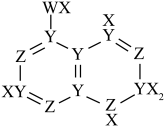

| A.元素的第一电离能:W>Z>Y |
| B.X、Z、W三种元素形成的化合物只能是共价化合物 |
| C.M分子中,X、Y、Z、W四种原子均满足8电子稳定结构 |
| D.Y与X,W形成的化合物有可能使酸性高锰酸钾溶液褪色 |
您最近半年使用:0次
2023-07-19更新
|
860次组卷
|
4卷引用:安徽省亳州市蒙城县五校联考2023-2024学年高三上学期11月期中考试化学试题
名校
2 . 短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物 的结构式为
的结构式为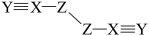 。下列说法正确的是
。下列说法正确的是
A.第一电离能: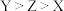 |
| B.W位于元素周期表的s区 |
C.电负性: |
D.简单气态氢化物的热稳定性: |
您最近半年使用:0次
2021-07-02更新
|
360次组卷
|
9卷引用:安徽省亳州市第二中学2021-2022学年高二下学期期末考试化学试题
安徽省亳州市第二中学2021-2022学年高二下学期期末考试化学试题江苏省徐州市2020-2021学年高二下学期期末抽测化学试题内蒙古赤峰二中2021-2022学年高二下学期第二次月考化学试题湖南省郴州市2021-2022学年高二下学期期末考试化学试题河南省开封市官庄乡联合中学2022-2023高三上学期开学考试化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题江西省九江市濂溪区第一中学2022-2023学年高二上学期期末考试化学试题陕西省汉中市西乡县第一中学2023-2024学年高二下学期3月月考化学试题江西省宜春市宜丰中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图___ ,E元素在周期表中的位置是___ 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为___ 。(选序号)
a.离子键 b.极性共价键 c.非极性共价键
(3)D与C按原子个数比为1:1形成化合物的电子式是___ 。
(4)B、C所形成简单氢化物的稳定性由强到弱的顺序是___ (填化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和化合物甲反应的离子方程式___ 。
(1)画出D的原子结构示意图
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为
a.离子键 b.极性共价键 c.非极性共价键
(3)D与C按原子个数比为1:1形成化合物的电子式是
(4)B、C所形成简单氢化物的稳定性由强到弱的顺序是
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和化合物甲反应的离子方程式
您最近半年使用:0次
名校
解题方法
4 . 短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法不正确 的是( )
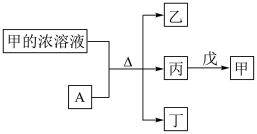

| A.简单离子半径大小:X>Y |
| B.气态氢化物的还原性:X<Z |
| C.丁和戊中所含元素种类相同 |
| D.W的简单离子与Z的简单离子在水溶液中可大量共存 |
您最近半年使用:0次
2020-06-02更新
|
417次组卷
|
8卷引用:安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题
名校
5 . A、B、C、D均为短周期主族元素,原子序数依次增大,其原子的最外层电子数之和为18,A和C同主族,B原子的电子层数与最外层电子数相等,B、C、D的单质均可与NaOH溶液反应。下列说法正确的是
| A.简单离子半径:D>B | B.简单氢化物的热稳定性:C>A |
| C.AD4的熔沸点比CD4的高 | D.可电解BD3溶液制备B的单质 |
您最近半年使用:0次
2020-04-03更新
|
606次组卷
|
6卷引用:安徽省亳州市涡阳县第九中学2019-2020学年高一下学期线上教学质量检测化学试题
6 . 同一周期的A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A________ ,B________ ,C________ ,D________ ,E________
(2)A与E两元素可形成化合物,用化学式表示化合物:________
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式:________
(1)写出下列元素符号:A
(2)A与E两元素可形成化合物,用化学式表示化合物:
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式:
您最近半年使用:0次
解题方法
7 . A、B、C、D、E、F是原子序数依次增大的六种常见元素,其中A原子最外层电子数比次外层电子数多2个电子;B的阴离子与C的阳离子电子数之和为20,质子数相差3;E2、EB2均是生活生产中常见的杀菌消毒剂;气体DB2中D的质量分数为50%;A与F形成一种化合物M可与水反应生成一种可燃性的直线型分子N。根据以上信息回答下列问题:
(1)用一个反应方程式说明D与E的非金属性强弱关系___________________________ 。
(2)M的电子式___________________________________________________ 。
(3)汽车安全气囊中的叠氮化钠NaN3可用次氯酸钠溶液销毁,写出反应的化学方程式:______________________ ,每生成1molN2,转移的电子数为_____________________________ 。
(4)自来水厂常用EB2对饮用水进行杀菌消毒,处理后的水中要求EB2的残留的浓度为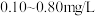 ,一般可用碘量法对其进行检测,现操作步骤如下:
,一般可用碘量法对其进行检测,现操作步骤如下:
Ⅰ、取1L水样加硫酸酸化,向其中加入足量的KI溶液,充分反应后,用NaOH溶液调节溶液至中性,加入淀粉溶液。
Ⅱ、用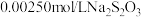 溶液滴定Ⅰ所得溶液,测得所用体积为
溶液滴定Ⅰ所得溶液,测得所用体积为
①步骤Ⅰ中EB2与碘化钾溶液反应的离子方程式为___________________________________ 。
②滴定终点的现象_________________________________________________________ 。
③步骤Ⅰ中调节溶液至中性的原因是________________________________________ 。
④该水样中EB2的浓度为______________________________ mg/L。(保留到小数点后两位)
(1)用一个反应方程式说明D与E的非金属性强弱关系
(2)M的电子式
(3)汽车安全气囊中的叠氮化钠NaN3可用次氯酸钠溶液销毁,写出反应的化学方程式:
(4)自来水厂常用EB2对饮用水进行杀菌消毒,处理后的水中要求EB2的残留的浓度为
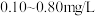 ,一般可用碘量法对其进行检测,现操作步骤如下:
,一般可用碘量法对其进行检测,现操作步骤如下:Ⅰ、取1L水样加硫酸酸化,向其中加入足量的KI溶液,充分反应后,用NaOH溶液调节溶液至中性,加入淀粉溶液。
Ⅱ、用
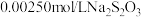 溶液滴定Ⅰ所得溶液,测得所用体积为
溶液滴定Ⅰ所得溶液,测得所用体积为
①步骤Ⅰ中EB2与碘化钾溶液反应的离子方程式为
②滴定终点的现象
③步骤Ⅰ中调节溶液至中性的原因是
④该水样中EB2的浓度为
您最近半年使用:0次
名校
解题方法
8 . 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______ ;B______ ;C______ ;D______ 。
(2)D元素位于周期表中______ 周期______ 族。
(3)写出AB2与C2B2反应的化学方程式______ 。
(4)画出B的原子结构简图______ 。
(1)元素名称:A
(2)D元素位于周期表中
(3)写出AB2与C2B2反应的化学方程式
(4)画出B的原子结构简图
您最近半年使用:0次
2020-02-15更新
|
295次组卷
|
3卷引用:安徽省亳州市第二完全中学2022-2023学年高一下学期期中考试化学试题
名校
9 . A、B、X、Y 和 Z 是原子序数依次递增的短周期元素。其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z 的最外层电子数之比为 2∶3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z 元素在元素周期表中的位置是______________ ,化合物 B2A4 的电子式为______________
(2)化合物A2X和A2Z中,沸点较高的是__________ (填化学式),其主要原因是_____________
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为___________________ , 由此可得出一氧化氮与ZX2的还原性大小关系为________________
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的离子方程式为:______________ ,并用单线桥标出此反应中电子转移的方向和数目。
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:_________
(1)Z 元素在元素周期表中的位置是
(2)化合物A2X和A2Z中,沸点较高的是
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的离子方程式为:
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:
您最近半年使用:0次
2018-04-28更新
|
508次组卷
|
4卷引用:安徽省亳州市涡阳县育萃高级中学2019-2020学年高二下学期摸底考试化学试题
名校
10 . A、B、C、D为短周期原子序数依次增大的主族元素。其中:只有D为金属元素;A的某种同素异形体是自然界最硬的物质。下列说法一定正确的是
| A.A、B、C三种元素最高价氧化物的水化物的酸性依次增强 |
| B.简单离子的半径大小顺序为:B>C>D |
| C.B、C分别与D形成的可溶于水的化合物的水溶液可以呈酸性、中性或碱性 |
| D.若B、C能形成化合物BC3,则该化合物中B的化合价为-3 |
您最近半年使用:0次
2018-04-27更新
|
248次组卷
|
4卷引用:安徽省亳州市涡阳县第九中学2019-2020学年高一下学期线上教学质量检测化学试题



