解题方法
1 . D、E、X、Y、Z为原子序数依次增大的短周期主族元素,它们的简单氢化物分子的空间结构依次是正四面体形、三角锥形、正四面体形、V形、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为_______ 。
(2)上述五种元素中,能形成酸性最强的含氧酸的元素是_______ ,该元素的任意3种含氧酸的化学式为_______ 。
(3)D和Y形成的化合物,其分子的空间结构为_______ 。
(4)D和X形成的化合物,其化学键类型属于_______ (填“共价键”或“离子键”)。
(5)金属镁和E的单质在高温下反应得到的产物是_______ (写化学式)。该产物与水反应生成两种碱,反应的化学方程式是_______ 。
(1)Y的最高价氧化物的化学式为
(2)上述五种元素中,能形成酸性最强的含氧酸的元素是
(3)D和Y形成的化合物,其分子的空间结构为
(4)D和X形成的化合物,其化学键类型属于
(5)金属镁和E的单质在高温下反应得到的产物是
您最近半年使用:0次
名校
解题方法
2 . 几种短周期元素的原子半径及主要化合价如下表:
已知X是短周期中最活泼的金属,且与R同周期。下列叙述正确的是
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A.M的氢化物比Y的氢化物稳定,因为M的氢化物中存在分子间氢键 |
| B.Z的一种单质化学性质稳定,可作为冶炼金属镁的保护气 |
| C.R原子最外层共有3种自旋状态相同的电子 |
| D.离子半径大小:R3+<X+<M2- |
您最近半年使用:0次
2022-05-09更新
|
56次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021-2022学年高二下学期5月月考化学试题
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。X的气态氢化物常用作制冷剂。 与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法错误的是
与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法错误的是
 与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法错误的是
与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法错误的是A.基态X原子的价电子排布图: |
B.第一电离能: |
C. 分子中,σ键与π键数目之比为3∶1 分子中,σ键与π键数目之比为3∶1 |
D.Z的简单氢化物分子中,Z原子的杂化轨道类型为 |
您最近半年使用:0次
2022-05-03更新
|
74次组卷
|
2卷引用:安徽省滁州市部分学校2021-2022学年高二下学期4月联考化学试题
4 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
| A.X的简单氢化物的热稳定性比W的强 |
| B.Y与X的简单离子具有相同的电子层结构 |
| C.Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 |
| D.Z与X属于同一主族,与Y属于同一周期 |
您最近半年使用:0次
2021-07-28更新
|
4226次组卷
|
73卷引用:安徽省定远县育才学校2021届高三上学期第二次月考化学试题
安徽省定远县育才学校2021届高三上学期第二次月考化学试题山西省康杰中学2016-2017学年高二下学期期末考试化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)山东省淄博市淄川中学2018届高三上学期开学考试化学试题广西灵山县第二中学2018届高三上学期开学考试化学试题陕西省西安中学2018届高三上学期第一次摸底考试化学试题新疆阿克苏市农一师中学2018届高三上学期第二次月考化学试题2018届广东省揭阳市高三上学期第一次月考化学试题浙江省嘉兴市第一中学2018届高三上学期期末考试化学试题浙江省嘉兴市第一中学2017-2018学年高二上学期期末考试化学试题(已下线)狂刷05 元素周期表和元素周期律的应用—《小题狂刷》2017-2018学年高一化学人教必修2重庆市第二中学2018届高三3月测试化学试题【全国区级联考】天津市和平区2018届高三下学期第二次质量调查化学试题(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密【全国市级联考】河南省周口市2017-2018学年高二下学期期末考试化学试题河北省磁县滏滨中学2017-2018学年高二下学期期末考试化学试题山东省淄博市淄川中学2019届高三上学期10月月考化学试题河南省辉县市第一高级中学2019届高三上学期第二次月考化学试题河北省隆化县存瑞中学2019届高三上学期期中考试化学试题【全国百强校】辽宁省大连市辽宁师范大学附属中学2019届高三上学期第一次考试化学试题【市级联考】广东省化州市2019年高三上学期第二次模拟考试理科综合化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】广西河池市高级中学2018-2019学年高二下学期第一次月考理综-化学试题(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题重庆市璧山大路中学校2018-2019学年高一下学期4月月考化学试题苏教版高二化学选修三单元测试题:2.2 元素性质的递变规律广东省北京师范大学东莞石竹附属学校2018-2019学年高一下学期期中考试化学试题(已下线)2019年6月26日《每日一题》选修3—— 元素推断技巧重庆市南岸区2018-2019学年高一下学期期末质量调研抽测化学试题百所名校联考-物质结构 元素周期律湖南省邵阳市邵东县第十中学2020届高三9月月考(读论班)化学试题(已下线)【新东方】高中化学5001广东省揭阳市第三中学2020届高三上学期第三次月考理综化学试题河北省张家口市第一中学2019-2020学年高二12月月考化学试题辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题第1章原子结构与元素周期律 挑战区 模拟高考第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题安徽省黄山市屯溪第一中学2019-2020学年高一下学期入学考试化学试题河北省衡水中学2020届高三四月份质量监测理综化学试题河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题四川省内江市市中区天立学校2019-2020学年高一下学期第二次月考化学试题(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测黑龙江省哈尔滨师范大学青冈实验中学校2020届高三10月月考化学试题四川省宜宾市第四中学2019-2020学年高一下学期期末模拟考试化学试题四川省成都艺术高级中学2020-2021学年高三上学期开学考试化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题浙江省金丽衢十二校2021届高三上学期第一次联考化学试题(已下线)练习12 原子核外电子的排布-2020-2021学年【补习教材·寒假作业】高一化学(人教版)专题5 第一单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)选择性必修2 第一章 原子结构与性质 章末总结(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 学科素养提升(已下线)第一单元 原子结构(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】安徽省蚌埠第三中学2020-2021学年高一下学期5月教学质量检测化学试题江西省宜春市丰城市第九中学2020-2021学年高一下学期月考化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(三)“位-构-性”综合推断题的解题方法(练) — 2022年高考化学一轮复习讲练测(新教材新高考)黑龙江省大庆实验中学2022届高三10月月考化学试题吉林省梅河口市第五中学2022届高三上学期第一次月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题(已下线)专题突破卷05?物质结构 元素周期律?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
5 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W和X组成两种常见的化合物甲和乙,常温下,甲、乙 均呈液态;其中,乙与由W和Z组成的化合物丙的电子数相同,乙与丙反应生成淡黄色固体;Y与W同 一主族。下列说法不正确的是
| A.X的简单离子的半径比Y的简单离子的半径大 |
| B.Y与Z形成的化合物可使溴水褪色 |
| C.甲与Y单质发生的反应属于非离子反应 |
| D.W、X、Y、Z四种元素可组成两种盐,其溶液混合产生刺激性气味的气体 |
您最近半年使用:0次
2021-03-30更新
|
200次组卷
|
3卷引用:安徽省滁州市定远县育才学校2020-2021学年高三3月月考理科综合化学试题
安徽省滁州市定远县育才学校2020-2021学年高三3月月考理科综合化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题1-5)山东省淄博市沂源县第一中学2022-2023学年高一下学期第二次月考化学试题
6 . 原子序数依次增大的W、X、Y、Z四种短周期主族元素,W、Y同周期且价电子数之和为10,W、Y可形成结构如图所示的阴离子,Z原子最外层有2个电子,下列说法错误的是
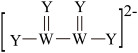
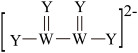
A.常见简单氢化物沸点: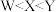 |
B.简单离子半径: |
C. 中两种元素的原子 中两种元素的原子 离子 离子 最外层均达到8电子结构 最外层均达到8电子结构 |
D.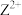 、 、 均能促进水的电离 均能促进水的电离 |
您最近半年使用:0次
2021-03-18更新
|
359次组卷
|
5卷引用:安徽省定远县育才学校2020届高三下学期第一次模拟考试化学试题
安徽省定远县育才学校2020届高三下学期第一次模拟考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
7 . A、B、C、D、E是原子序数依次增大的短周期主族元素、F是一种常见的过渡元素,C与A、B、D均可形成两种常见化合物,且这些化合物中的某些物质反应又可生成C的单质,E位于金属与非金属分界线旁且其氧化物与盐酸、NaOH溶液均能反应,F的一种氯化物常用于制备红褐色液溶胶X。
(1)写出上述元素形成的某种酸性气体的电子式为___________ 。
(2) 、C、D、E元素形成的常见离子半径由大到小的顺序为
、C、D、E元素形成的常见离子半径由大到小的顺序为___________ 。
(3)写出两种由上述元素形成的含有两类化学键物质的化学式___________ 。
(4)举例说明单质E、F还原性的相对强弱:___________ 。
(5)用化学方程式表示出实验室制备X的原理:___________ 。
(1)写出上述元素形成的某种酸性气体的电子式为
(2)
 、C、D、E元素形成的常见离子半径由大到小的顺序为
、C、D、E元素形成的常见离子半径由大到小的顺序为(3)写出两种由上述元素形成的含有两类化学键物质的化学式
(4)举例说明单质E、F还原性的相对强弱:
(5)用化学方程式表示出实验室制备X的原理:
您最近半年使用:0次
名校
8 . 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,Z原子的M层上的电子数为2;f是W的固体单质,W元素形成的化合物种类最多。下列有关说法不正确的是
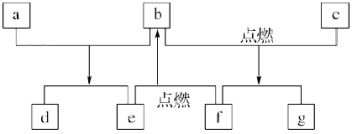

A.原子半径: |
| B.化合物a、d中阴阳离子数目之比相同 |
C. 化合物b中共用电子对数目为4 化合物b中共用电子对数目为4 |
| D.a中既含离子键,又含非极性键 |
您最近半年使用:0次
2021-03-04更新
|
294次组卷
|
2卷引用:安徽省滁州市定远县育才学校2020-2021学年高一下学期开学考试化学试题
名校
解题方法
9 . 如图是某另类元素周期表的一部分,下列说法正确的是
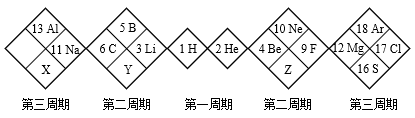

A.单质的氧化性: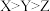 | B.简单阴离子的还原性: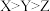 |
C. 只有一种氢化物 只有一种氢化物 | D. 的最高价氧化物对应的水化物为强酸 的最高价氧化物对应的水化物为强酸 |
您最近半年使用:0次
2021-02-01更新
|
472次组卷
|
7卷引用:安徽省滁州市定远县民族中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
10 . 短周期主族元素W、X、Y、Z、M、N、Q原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,X与M同主族,Z与N同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是______ 。
(2)化合物p由W、X、Y、N四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热,可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为______ 。
(3)由X、Y、Z三种元素可组成摩尔质量为84 g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为______ 。
(4)(XY)2的性质与单质Q2相似,(XY)2与NaOH溶液常温下反应的离子方程式为______ 。
(5)常温下,1 mol Z3能与Y的最简单氢化物反应,生成一种常见的含氧酸盐和1 mol Z2,该反应的化学方程式为______ 。
(6)Z元素与除M外的其余五种元素间两两形成的化合物都不止一种,写出符合下列条件的化合物分子式_____
①Z与其它原子的个数比为2:1;
②分子中电子总数为奇数
(7)用如图的装置,既可设计比较X、M、N非金属性强弱的实验,也可设计比较N、Q非金属性强弱的实验。若用强酸制弱酸的原理比较X、M、N非金属性强弱,则A装置中发生反应的化学方程式是_______ ;若用氧化还原反应原理比较N、Q非金属性强弱,则B装置中发生反应的离子方程式是________ (此空供选用的实验试剂有:KMnO4固体、MnO2固体、稀盐酸、浓盐酸、Na2S溶液、Na2SO3溶液、NaOH溶液)。
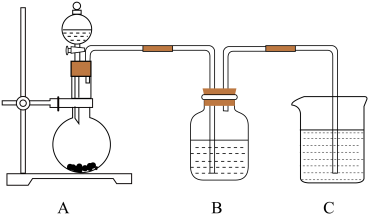
(1)M在元素周期表中的位置是
(2)化合物p由W、X、Y、N四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热,可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为
(3)由X、Y、Z三种元素可组成摩尔质量为84 g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为
(4)(XY)2的性质与单质Q2相似,(XY)2与NaOH溶液常温下反应的离子方程式为
(5)常温下,1 mol Z3能与Y的最简单氢化物反应,生成一种常见的含氧酸盐和1 mol Z2,该反应的化学方程式为
(6)Z元素与除M外的其余五种元素间两两形成的化合物都不止一种,写出符合下列条件的化合物分子式
①Z与其它原子的个数比为2:1;
②分子中电子总数为奇数
(7)用如图的装置,既可设计比较X、M、N非金属性强弱的实验,也可设计比较N、Q非金属性强弱的实验。若用强酸制弱酸的原理比较X、M、N非金属性强弱,则A装置中发生反应的化学方程式是

您最近半年使用:0次



