名校
1 . Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法不正确 的是
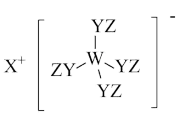
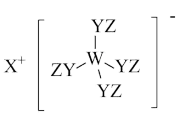
A.简单氢化物的稳定性: |
B.该物质中所有原子均满足最外层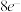 的稳定结构 的稳定结构 |
| C.X与Y、Y与Z均可形成含非极性共价键的化合物 |
| D.W与X两者的最高价氧化物对应的水化物之间可发生反应 |
您最近一年使用:0次
2022-01-25更新
|
911次组卷
|
8卷引用:浙江省舟山市2022届高三下学期第三次模拟化学试题
名校
2 . 重氮化合物是一类活泼的化合物,在有机合成方面有着重要应用。重氮化合物A在光照及甲醇参与反应的条件下经过一系列活泼中间体转化为F的路线如下:

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为_______ 。
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为_______ ;上述路线中与B1、B2互为同分异构体的是_______ (填标号);核磁共振氢谱、核磁共振碳谱都常用于分析有机化合物的结构,B1或B2的核磁共振碳谱有_______ 种碳原子的吸收峰。
(3)从结果上看,C和CH3OH生成E的反应类型为_______ ;写出CH2=C=O与CH3CH2OH反应的化学方程式_______ (不要求写出中间体)。
(4)E不稳定,能自发转化为F,说明稳定性C=O_______ C=C(填“大于”“小于”或“等于”),理由是_______ (从化学键的角度说明)。
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为_______ ;平衡时X、Y的物质的量之比n(X):n(Y)=3:2,则X转化为Y的平衡转化率为_______ 。

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为
(3)从结果上看,C和CH3OH生成E的反应类型为
(4)E不稳定,能自发转化为F,说明稳定性C=O
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为
您最近一年使用:0次
2021-03-04更新
|
406次组卷
|
2卷引用:云南省昆明市第一中学2021届高三第六次复习检测理科综合化学试题
名校
3 . 化合物甲是一种常见无机物,其结构如下图所示(图中的“—”为单键或双键),其中W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X和Z分别为同主族元素,其四种元素原子的最外层电子数之和为14.下列叙述正确的是( )
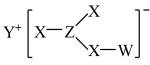
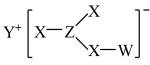
| A.W分别与X、Z形成的简单分子均为10电子微粒 |
| B.X、Y形成的离子化合物只含离子键 |
| C.X、Y、Z三种元素的简单离子半径大小顺序为Z>X>Y |
| D.等物质的量Y和Z的最高价氧化物对应的水化物反应生成甲 |
您最近一年使用:0次
2020-09-14更新
|
2895次组卷
|
12卷引用:天一大联考“顶尖计划”2021届高三第一次考试化学试题
天一大联考“顶尖计划”2021届高三第一次考试化学试题黑龙江省大庆实验中学2021届高三上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2021届高三10月月考化学试题(已下线)【南昌新东方】6 2020年10月江西南昌-江科附中-高三-上学期-月考化学卷四川省绵阳市涪城区绵阳南山中学2021届高三上学期11月月考理综化学试题重庆市第七中学2021届高三上学期期中化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市长郡中学2021-2022学年高三下学期月考考试(第六次)化学试题江苏省沛县中学2022-2023学年高三上学期12月月考化学试题(已下线)练习13 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)河南省商丘市第一高级中学2021-2022学年高一下学期开学测试化学试题山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________ 。
(2)下列关于物质结构与性质的说法,正确的是________ 。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测 的空间构型为
的空间构型为______ ,中心原子S的杂化方式为________ ,[Ag(S2O3)2]3-中存在的化学键有________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________ 。
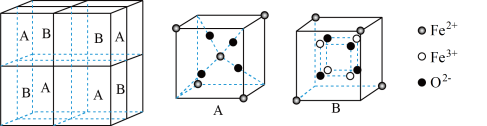
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____ ,已知该晶体的晶胞参数为a nm,阿伏加 德罗常数的值为NA,则密度ρ为______ g·cm-3(用含a和NA的代数式表示)。
(1)基态S的价电子排布图为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测
 的空间构型为
的空间构型为A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为

您最近一年使用:0次
5 . 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________ ;磷原子核外有_____ 种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______ 。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________ 。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________ ,判断理由是____________ 。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为___________ 。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:
(2)上述反应的反应物和生成物中含有非极性键的分子是
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列
(4)NH3的稳定性比PH3的(填“强”或“弱”)
(5)A、配平上述反应,并标出电子转移方向与数目
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为
您最近一年使用:0次
名校
解题方法
6 . X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z间形成的某种化合物是一种常用的漂白剂、供氧剂,R和Z位于同一周期且基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀,后转化为深蓝色溶液Q。请回答下列问题:
(1)基态M2+的核外电子排布式为__ ,Y、Z、R、M四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)化合物XCl3的中心原子的杂化类型为__ ,RCl3的立体构型为__ ,XCl3、RCl3分子中属于非极性分子的是__ ;导致Q溶液显色的粒子中存在的化学键类型有__ 与配位键。
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是__ 。
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是__ ,该晶体的化学式为___ 。
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=__ g·cm-3。
(1)基态M2+的核外电子排布式为
(2)化合物XCl3的中心原子的杂化类型为
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=
您最近一年使用:0次
7 . W、N、X、Y、Z是原子序数依次增大的短周期主族元素。Y所处的周期序数与族序数相等。甲、乙、丙、丁、戊是由这些元素组成的化合物,丁是氯碱工业的-种产物,戊为二元化合物,常温下0.01 mol·L— 1戊溶液的pH为2。上述物质的转化关系如图所示。下列说法中错误的是

| A.原子半径: N<Y<X | B.W2N分子的比例模型为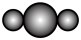 |
| C.物质丁中含有离子键和共价键 | D.丙在固态时属于分子晶体 |
您最近一年使用:0次
解题方法
8 . 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题(用所对应的元素符号表示)。
(1)R在基态时价层电子排布式为________ 。
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式___________ 。
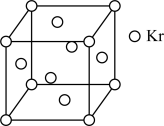
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=__ (填数字)。
(4)1 mol晶体L中含有σ键的数目为________ 。
(5)G与M可形成MG3与MG2,MG3分子的空间构型是___ ,
MG2中M原子的杂化方式___ 。
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有________ (填字母)。
a.离子键b.氢键c.配位键d.金属键
(1)R在基态时价层电子排布式为
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=

(4)1 mol晶体L中含有σ键的数目为
(5)G与M可形成MG3与MG2,MG3分子的空间构型是
MG2中M原子的杂化方式
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有
a.离子键b.氢键c.配位键d.金属键
您最近一年使用:0次
解题方法
9 . 【化学——选修3:物质结构与性质】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显____ 价,A的电负性______ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因___________ ;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 __________________ ;
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_______________ ;其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 _______ 个。
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________ (填字母);
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为______ g/cm3(用含a、NA的式子表示)。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为
您最近一年使用:0次
11-12高三上·甘肃天水·阶段练习
解题方法
10 . 短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,1 molF中含有10mol原子。
请回答下列问题:
(1)C的气态氢化物的电子式为______ ,A在周期表中的位置______
(2)化合物E2D2中阴阳离子个数比为______ ,F含有的化学键类型为______
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为______
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式并用单线桥表示电子转移的方向和数目______
(5)将A2、D2分别充人多孔性石墨电极,将电极插入EDA的水溶液中构成原电池,负极的电极反应为______ ;一段时间后EDA的浓度将______ (填“变大”、“变小”、“不变”或“无法确定”)。
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,1 molF中含有10mol原子。
请回答下列问题:
(1)C的气态氢化物的电子式为
(2)化合物E2D2中阴阳离子个数比为
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式并用单线桥表示电子转移的方向和数目
(5)将A2、D2分别充人多孔性石墨电极,将电极插入EDA的水溶液中构成原电池,负极的电极反应为
您最近一年使用:0次



