1 . ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____ ,在与其他元素形成化合物时,呈现的最高化合价为_____ 。
(2)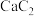 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为_____ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是
,其中电负性最大的元素是_____ ,硅原子的杂化轨道类型为_____ 。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____ 。
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为_____ 。设 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为_____  (列出计算式)。
(列出计算式)。
(1)该族元素基态原子核外未成对电子数为
(2)
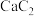 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷
 ,其中电负性最大的元素是
,其中电负性最大的元素是(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:
| 物质 | 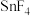 |  |  | 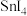 |
熔点/ | 442 | 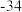 | 29 | 143 |
(5)结晶型
 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-06-14更新
|
5929次组卷
|
8卷引用:山东省临沂第十九中学2023-2024学年高二下学期第五次质量调研化学试题
山东省临沂第十九中学2023-2024学年高二下学期第五次质量调研化学试题2024年全国甲卷理综化学试题(已下线)2024年高考化学真题完全解读(全国甲卷)(已下线)12物质结构与性质综合(已下线)T35-结构综合题(已下线)暑假作业16 掌握物质结构与性质综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)河南省南阳市第一中学校2023-2024学年下学期高二第二次月考(6月)化学试题(已下线)河南省鹤壁市高中2024-2025学年高三上学期7月月考化学试题
名校
2 . 固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
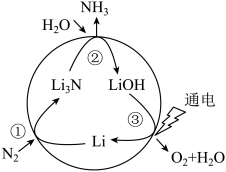
| A.反应①②③均为氧化还原反应 |
| B.转化过程中所涉及的元素均呈现了两种价态 |
C.假设每一步均完全转化,每生成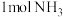 ,同时生成 ,同时生成 |
| D.参与反应的物质中含有的化学键有离子键、共价键和氢键 |
您最近一年使用:0次
2021-09-29更新
|
1522次组卷
|
17卷引用:山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题
山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题广东省深圳大学附属中学2022届高三9月调研考试化学试题河北省河北衡水中学2021届高三下学期第一次调研考试化学试题(已下线)2022年新高考化学时事热点情境化考题---物质循环图河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题(已下线)第15周 晚练题-备战2022年高考化学周测与晚练(新高考专用)湖北省黄冈市2021-2022学年高三上学期11月联考化学试题福建泉州城东中学、南安华侨中学、惠安高级中学、泉港第二中学2021-2022高三上学期期中考试化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题天津市耀华中学2021-2022学年高三上学期第二次月考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)天津市耀华中学2022-2023学年高一下学期期中考试化学试题河北省唐山市开滦第一中学2022-2023学年高三上学期11月期中考试化学试题天津市第八中学2023-2024学年高三上学期第一次大单元教学(9月月考)化学试题天津市第二十中学2023-2024学年高一下学期学情调研(二)(期中)化学试卷
名校
3 . 钛酸钡粉体是电子陶瓷元器件的重要基础原料。钛酸钡晶体与 的结构如图。
的结构如图。
 的结构如图。
的结构如图。
| A.钛酸钡晶体中Ba和Ti的配位数分别为12和6 |
B. 中含有的化学键为离子键、共价键、氢键、配位键 中含有的化学键为离子键、共价键、氢键、配位键 |
C. 中Ti的杂化方式为 中Ti的杂化方式为 |
D.1mol  通过螯合作用形成的配位键有5mol 通过螯合作用形成的配位键有5mol |
您最近一年使用:0次
2024-05-29更新
|
373次组卷
|
3卷引用:2024年山东省青岛市高三下学期三模化学试题
2024年山东省青岛市高三下学期三模化学试题(已下线)专题03 物质结构与性质-【好题汇编】5年(2020-2024)高考1年模拟化学真题分类汇编(山东专用)陕西省宝鸡中学2024-2025学年高三上学期10月月考化学试题
名校
解题方法
4 . 下列说法中正确的是
①非金属元素不可能形成离子化合物 ②位于第四周期第VA族的元素为非金属元素
③可用质谱法区分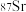 和
和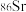 ④金属晶体的导电性、导热性均与自由电子有关
④金属晶体的导电性、导热性均与自由电子有关
⑤分子晶体中一定存在共价键 ⑥金刚石与石墨中的C―C―C夹角都为120°
⑦NaCl晶体中,阴离子周围紧邻的阳离子数为6
⑧NaClO和NaCl均为离子化合物,它们所含的化学键类型完全相同
①非金属元素不可能形成离子化合物 ②位于第四周期第VA族的元素为非金属元素
③可用质谱法区分
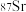 和
和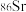 ④金属晶体的导电性、导热性均与自由电子有关
④金属晶体的导电性、导热性均与自由电子有关⑤分子晶体中一定存在共价键 ⑥金刚石与石墨中的C―C―C夹角都为120°
⑦NaCl晶体中,阴离子周围紧邻的阳离子数为6
⑧NaClO和NaCl均为离子化合物,它们所含的化学键类型完全相同
| A.①③④⑥ | B.②③④⑦ | C.②③④⑤ | D.②③④⑧ |
您最近一年使用:0次
2024-02-22更新
|
362次组卷
|
4卷引用:山东省青岛市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 二茂铁 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是| A.二茂铁属于分子晶体 |
B.在二茂铁中,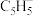 与 与 之间形成的化学键类型是离子键 之间形成的化学键类型是离子键 |
C.已知环戊二烯的结构式为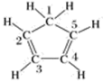 ,则其中仅有1个碳原子采取 ,则其中仅有1个碳原子采取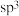 杂化 杂化 |
D.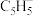 中一定含有 中一定含有 键 键 |
您最近一年使用:0次
2021-10-14更新
|
1130次组卷
|
25卷引用:山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题
山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省菏泽市鄄城县第一中学2022-2023学年高二下学期4月月考化学试题2017届安徽省安庆市怀宁中学等六校高三第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)福建省厦门双十中学2018-2019学年高二下学期期中考试化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第四次质量监测化学试题福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题全书综合测评-苏教版选择性必修2第三章 本章达标检测2山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期末考试化学试题河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题福建省莆田第二十五中学2023-2024学年高二下学期第一次质量检化学试题
名校
6 . 元素X、Y、Z、M、N、R均为短周期主族元素,且原子序数依次增大。X与Y可形成原子个数比为 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
(1)R在元素周期表中的位置为___________ 。
(2)R、Z、M、N的简单离子半径由大到小的顺序为___________ 。(填离子符号)。
(3)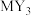 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为___________ 。
(4)M、N的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)A能与B反应生成无毒气体,该反应的化学方程式为___________ 。
 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:(1)R在元素周期表中的位置为
(2)R、Z、M、N的简单离子半径由大到小的顺序为
(3)
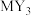 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为(4)M、N的最高价氧化物对应的水化物反应的离子方程式为
(5)A能与B反应生成无毒气体,该反应的化学方程式为
您最近一年使用:0次
2023-07-12更新
|
324次组卷
|
3卷引用:山东省济南市2022-2023学年高一下学期期末考试化学试题
7 . 设NA为阿伏加德罗常数的值。下列关于C、Si及其化合物的叙述错误的是
| A.碳元素存在12C、13C、14C等多种同位素 |
| B.原子半径Si大于C,使得硅原子间难以形成双键 |
| C.碳和二氧化硅反应制粗硅,每生成28g硅有2NA个硅氧键断裂 |
D.12g金刚石中含有的晶胞数目为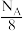 |
您最近一年使用:0次
2022-04-14更新
|
668次组卷
|
4卷引用:山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题
山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题山东省滨州市2023届高三上学期期末综合测试化学试题(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第一中学校2022-2023学年高一下学期3月月考化学试题
名校
8 . 氢化铝锂以其优良的还原性广泛应用于医药、农药、香料、染料等行业,而且还是一种潜在的储氢材料,其释氢过程可用化学方程式表示为3LiAlH4=Li3AlH6+2Al+3H2↑,其晶胞结构如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是


| A.氢化铝锂中含有离子键、共价键、配位键 |
B.AlH 的VSEPR模型为正四面体结构 的VSEPR模型为正四面体结构 |
| C.当氢化铝锂释放1mol氢气时,将有2molAl3+被还原 |
D.该晶胞的密度为 g/cm3 g/cm3 |
您最近一年使用:0次
名校
9 . 青蒿素(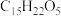 ,
,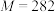 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体)及分子结构如下图所示。下列说法错误的是
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体)及分子结构如下图所示。下列说法错误的是
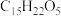 ,
,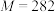 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体)及分子结构如下图所示。下列说法错误的是
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体)及分子结构如下图所示。下列说法错误的是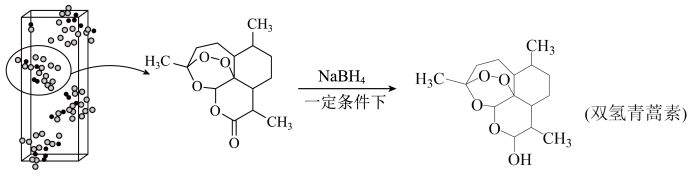
| A.青蒿素分子中既有极性键又有非极性键 |
| B.双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好 |
C.若图中晶胞的棱长分别为 、 、 、 、 ,晶体的密度为 ,晶体的密度为 |
| D.利用红外光谱法测定原子的空间位置、原子间存在的化学键及键长和键角 |
您最近一年使用:0次
2023-09-07更新
|
267次组卷
|
3卷引用:山东省新高考联合质量测评2023-2024学年高三上学期开学考试化学试题
名校
10 . 有关化学键的说法错误的是
| A.存在离子键的物质一定是离子化合物 |
| B.化学键是相邻原子或离子之间的强烈的相互作用,该作用只表现为吸引力 |
| C.存在共价键的物质可能为单质,可能是共价化合物,也可能是离子化合物 |
| D.化学键的强度远大于分子间作用力,一般而言化学键强度也强于氢键 |
您最近一年使用:0次
2023-10-04更新
|
237次组卷
|
3卷引用:山东省泰安市泰山国际学校2023-2024学年高一下学期期末考试化学试题



