1 . 某汽车安全气囊的气体发生剂主要为 、
、 、
、 、
、 。当汽车发生碰撞时,
。当汽车发生碰撞时, 分解产生大量
分解产生大量 使气囊迅速膨胀,从而起到保护作用。下列说法错误的是
使气囊迅速膨胀,从而起到保护作用。下列说法错误的是
 、
、 、
、 、
、 。当汽车发生碰撞时,
。当汽车发生碰撞时, 分解产生大量
分解产生大量 使气囊迅速膨胀,从而起到保护作用。下列说法错误的是
使气囊迅速膨胀,从而起到保护作用。下列说法错误的是A. 的电子式为: 的电子式为: |
B. 中既含有离子键又含有共价键 中既含有离子键又含有共价键 |
C.基态Fe的核外价电子轨道表示式为 |
D. 水溶液中存在 水溶液中存在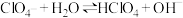 |
您最近一年使用:0次
名校
2 . 已知由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐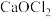 中加入足量浓硫酸,发生反应:
中加入足量浓硫酸,发生反应: 。下列说法错误的是
。下列说法错误的是
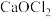 中加入足量浓硫酸,发生反应:
中加入足量浓硫酸,发生反应: 。下列说法错误的是
。下列说法错误的是A.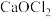 中的两种酸根阴离子分别为 中的两种酸根阴离子分别为 和 和 |
B.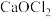 中不含非极性共价键 中不含非极性共价键 |
| C.在上述反应中,浓硫酸不体现氧化性 |
D.每产生0.1mol ,转移电子的数目约为 ,转移电子的数目约为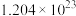 |
您最近一年使用:0次
2021-10-11更新
|
289次组卷
|
4卷引用:山东省潍坊市2022届高三10月份阶段性检测化学试题
名校
3 . 普鲁士蓝的化学式为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A.该物质中 与 与 数目之比为 数目之比为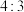 |
B. 该物质中含 该物质中含 数目为 数目为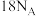 |
| C.该物质中只存在共价键和配位键,不存在离子键 |
D. 的核外电子排布式为 的核外电子排布式为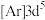 |
您最近一年使用:0次
2021-05-21更新
|
348次组卷
|
5卷引用:山东省潍坊市四县市(安丘,诸城,五莲,兰山)2021届高考模拟化学试题
名校
4 . X、Y、Z、M是原子序数依次增大的短周期主族元素。X和M处于同一主族,Y原子的最外层电子数为3,Z是非金属性最强的元素,X、Y和M可组成MYX4化合物,其结构如图所示。下列说法错误的是


| A.YZ3中每个原子最外层电子均达到8 |
| B.MYX4能与H2O发生氧化还原反应生成H2 |
| C.MX、XZ晶体中含有不同的化学键 |
| D.原子半径由大到小顺序为M>Y>Z>X |
您最近一年使用:0次
2021-04-22更新
|
407次组卷
|
4卷引用:山东省潍坊市临朐县第一中学2021-2022学年高三上学期10月月考化学试题
名校
5 . 某学校实验小组发现,可用如下两种方法制备 :
:
①NaBiO3(铋酸钠)和稀硫酸酸化的MnSO4溶液:NaBiO3+Mn2++H+→Na++Bi3++ +H2O;
+H2O;
②将(NH4)2S2O8溶液和MnSO4溶液混合:Mn2++ +___________→
+___________→ +
+ +___________。
+___________。
下列有关说法正确的是
 :
:①NaBiO3(铋酸钠)和稀硫酸酸化的MnSO4溶液:NaBiO3+Mn2++H+→Na++Bi3++
 +H2O;
+H2O;②将(NH4)2S2O8溶液和MnSO4溶液混合:Mn2++
 +___________→
+___________→ +
+ +___________。
+___________。下列有关说法正确的是
| A.NaBiO3能溶于水,属于强电解质 |
| B.NaBiO3可与浓盐酸发生反应:NaBiO3+HCl=HBiO3+NaCl |
C. S2O 中既存在非极性键又存在极性键 中既存在非极性键又存在极性键 |
D.制备1 mol  ,两种方法转移的电子数相等,而消耗氧化剂物质的量不同 ,两种方法转移的电子数相等,而消耗氧化剂物质的量不同 |
您最近一年使用:0次
名校
解题方法
6 . 以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得低密度聚乙烯(LDPE),该反应过程的机理如图所示下列说法正确的是( )
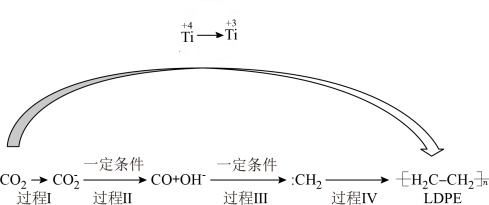

| A.过程Ⅰ~Ⅲ中碳元素均发生还原反应 |
| B.﹕CH2这个8电子微粒中既包含极性共价键又包含非极性共价键 |
| C.工业上生产7×103kg的LDPE,理论上需要CO2的体积是1.12×107L |
D.CO2最终转化为LDPE的电极反应式是2nCO2-12e-+12nH+=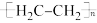 +4nH2O +4nH2O |
您最近一年使用:0次
解题方法
7 . 我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________ 种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、 分子中O-H键的极性最强的是
分子中O-H键的极性最强的是_____________ 。
②C、N、O三种元素的电负性由大到小的顺序是_____________ 。
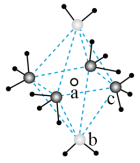
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________ mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________ 。
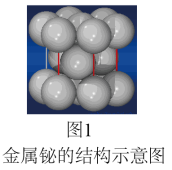
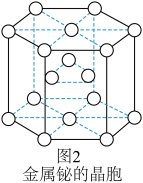
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________ g•cm-3 (用含r和NA数学表达式表示)。
(1)钛(Ti)的基态原子M能层中能量不同的电子有
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、
 分子中O-H键的极性最强的是
分子中O-H键的极性最强的是②C、N、O三种元素的电负性由大到小的顺序是
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为

(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为


您最近一年使用:0次
名校
解题方法
8 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___ (填元素符号)。
(2)b单质分子中σ键与π键的个数比为___ 。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___ ;这两种物质的互溶物中,存在的化学键有___ (填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___ (填化学式,下同);酸根呈正三角形结构的酸是___ ,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___ 酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___ 区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为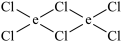 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键___ 。
回答下列问题:
(1)b、c、d电负性最大的是
(2)b单质分子中σ键与π键的个数比为
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是
(5)元素e在周期表中的位置是
 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键
您最近一年使用:0次
2019-12-02更新
|
527次组卷
|
4卷引用:山东省潍坊市2020届高三9月月考化学试题
山东省潍坊市2020届高三9月月考化学试题山东省潍坊市2019—2020学年高三上学期10月质量检测化学试题(已下线)易错点15 化学键-备战2023年高考化学考试易错题北京市十一学校2023-2024学年高三一模化学试题
9 . 如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是


| A.e、f单质晶体熔化时克服的是共价键 |
| B.d单质对应元素原子的电子排布式:1s22s22p63s23p2 |
| C.b元素形成的气态氢化物易与水分子之间形成氢键 |
| D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键 |
您最近一年使用:0次
2019-12-02更新
|
277次组卷
|
6卷引用:山东省潍坊市2020届高三9月月考化学试题



