1 . 氨硼烷是一种有效、安全的固体储氢材料,氨硼烷的结构和乙烷相似,如下图。

(1)氨硼烷的晶体类型为___________ 。
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为___________ 、___________ 。
(3)氨硼烷晶体中存在的作用力有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.π键 G.范德华力

(1)氨硼烷的晶体类型为
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为
(3)氨硼烷晶体中存在的作用力有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.π键 G.范德华力
您最近一年使用:0次
2 . 离子晶体中除含有离子键外,是否含有共价键?_______
您最近一年使用:0次
21-22高二·全国·课时练习
名校
解题方法
3 . 如图表示不同类型共价键形成时电子云重叠情况:
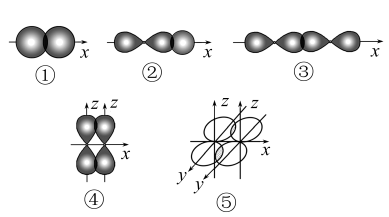
(1)其中形成的化学键属于轴对称的有_______ 。
(2)下列物质中,通过方式①化学键形成的是_______ ;通过方式②化学键形成的是_______ ;只通过方式③化学键形成的是_______ ;同时含有③、④、⑤三种方式化学键的物质是_______ 。
A.Cl2 B.HCl C.N2 D.H2
(3)某有机物分子的结构简式为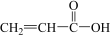 ,该分子中有
,该分子中有_______ 个σ键,有_______ 个π键,有_______ 种极性键,_______ (填“有”或“没有”)非极性键。

(1)其中形成的化学键属于轴对称的有
(2)下列物质中,通过方式①化学键形成的是
A.Cl2 B.HCl C.N2 D.H2
(3)某有机物分子的结构简式为
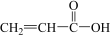 ,该分子中有
,该分子中有
您最近一年使用:0次
2021-12-25更新
|
1042次组卷
|
4卷引用:2.1.1 共价键的类型-σ键和π键-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
(已下线)2.1.1 共价键的类型-σ键和π键-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.1.1 共价键-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)第一章 有机化合物的结构特点与研究方法(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题
名校
4 . 表为元素周期表中短周期元素的一部分,表中所列的字母分别代表一种元素。
(1)a、b、c、d、e、f六种元素的原子半径最大的是_______ (填元素符号)。
(2)d、e两种元素的最高价氧化物对应水化物的碱性较强的物质俗称为_______ , 、
、 的沸点较高的是
的沸点较高的是_______ (填化学式)。
(3)过量的 与
与 溶液能发生反应,写出反应的离子方程式:
溶液能发生反应,写出反应的离子方程式:_______ 。
(4)化学式为 的化合物属于
的化合物属于_______ (填“离子化合物”或“共价化合物”),其中含有的化学键的类型为_______ 。
| a | |||||||
| b | c | ||||||
| d | e | f |
(2)d、e两种元素的最高价氧化物对应水化物的碱性较强的物质俗称为
 、
、 的沸点较高的是
的沸点较高的是(3)过量的
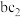 与
与 溶液能发生反应,写出反应的离子方程式:
溶液能发生反应,写出反应的离子方程式:(4)化学式为
 的化合物属于
的化合物属于
您最近一年使用:0次
名校
解题方法
5 . 下表是元素周期表的一部分,用化学用语回答下列有关问题:
(1)写出下列元素符号:①_______ ,画出原子的结构示意图:④_______ 。
(2)在①—⑫元素中,金属性最强的元素与⑦元素形成化合物中化学键是_______ 。
(3)元素⑦与元素⑧相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
a.常温下⑦的单质和⑧的单质状态不同
b.③的氢化物比⑦的氢化物稳定
c.一定条件下⑦和③的单质都能与氢氧化钠溶液反应
(4)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素可以形成_______ (填“离子”或“共价”)化合物,用电子式表示其形成过程:_______ 。①的+4价氧化物被烧碱溶液吸收生成两种钠盐的离子方程是_______ 。
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种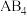 型化合物,请写出该化合物的电子式:
型化合物,请写出该化合物的电子式:_______ 。
(6) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成
在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成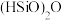 等,写出该反应的化学方程式
等,写出该反应的化学方程式_______ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ⑧ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在①—⑫元素中,金属性最强的元素与⑦元素形成化合物中化学键是
(3)元素⑦与元素⑧相比,非金属性较强的是
a.常温下⑦的单质和⑧的单质状态不同
b.③的氢化物比⑦的氢化物稳定
c.一定条件下⑦和③的单质都能与氢氧化钠溶液反应
(4)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素可以形成
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种
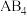 型化合物,请写出该化合物的电子式:
型化合物,请写出该化合物的电子式:(6)
 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成
在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成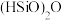 等,写出该反应的化学方程式
等,写出该反应的化学方程式
您最近一年使用:0次
6 . 在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入计量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式___ 。四碘化二磷中磷的氧化数为___ ,磷酸中磷的氧化数为____ ,A中磷的氧化数为___ 。
您最近一年使用:0次
7 . 近年来,有科学家提出,使用氯气消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯( ,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用 与
与 在
在 存在下制得
存在下制得 。
。
①该反应的离子方程式为___________ 。
②每生成 ,消耗还原剂的物质的量为
,消耗还原剂的物质的量为___________  ,转移的电子数为
,转移的电子数为___________  。
。
(2)实验室以 、盐酸、
、盐酸、 为原料,通过图中流程制备
为原料,通过图中流程制备 。
。

① 属于
属于___________ (填“离子化合物”或“共价化合物”), 分子内存在
分子内存在___________ (填“极性键”、“非极性键”或“极性键和非极性键”)。
②除去 中的
中的 可选用的试剂是
可选用的试剂是___________ (填标号)。
a. 固体氯化钙
b. 澄清石灰水
c. 浓硫酸
d. 饱和食盐水
③ 溶液和
溶液和 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
 ,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:(1)工业上可用
 与
与 在
在 存在下制得
存在下制得 。
。①该反应的离子方程式为
②每生成
 ,消耗还原剂的物质的量为
,消耗还原剂的物质的量为 ,转移的电子数为
,转移的电子数为 。
。(2)实验室以
 、盐酸、
、盐酸、 为原料,通过图中流程制备
为原料,通过图中流程制备 。
。
①
 属于
属于 分子内存在
分子内存在②除去
 中的
中的 可选用的试剂是
可选用的试剂是a. 固体氯化钙
b. 澄清石灰水
c. 浓硫酸
d. 饱和食盐水
③
 溶液和
溶液和 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 双氧水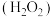 是一种医用消毒杀菌剂,已知
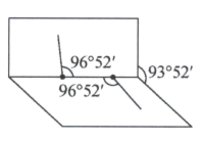
是一种医用消毒杀菌剂,已知 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个
分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个 键与
键与 键的夹角均为96°52′。试回答:
键的夹角均为96°52′。试回答:
(1) 分子中存在
分子中存在___________ 键和___________ 键,为___________ 分子。(填“极性”或“非极性”)
(2) 难溶于
难溶于 ,其原因是
,其原因是___________ 。
(3) 分子中氧元素的化合价为
分子中氧元素的化合价为___________ 价。
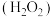 是一种医用消毒杀菌剂,已知
是一种医用消毒杀菌剂,已知 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个
分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个 键与
键与 键的夹角均为96°52′。试回答:
键的夹角均为96°52′。试回答:
(1)
 分子中存在
分子中存在(2)
 难溶于
难溶于 ,其原因是
,其原因是(3)
 分子中氧元素的化合价为
分子中氧元素的化合价为
您最近一年使用:0次
解题方法
9 . (1)乙醇和二甲醚互为同分异构体,乙醇的沸点(78.5℃)远高于二甲醚的沸点(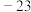 ℃),原因是
℃),原因是_______ 。
(2) 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
的电子式_______ 。
 ℃),原因是
℃),原因是(2)
 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
的电子式
您最近一年使用:0次
名校
10 . 环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1)基态Cu原子的价电子排布___________ 。
(2)镍的氨合离子 中存在的化学键有
中存在的化学键有___________ 。
A.离子键 B.共价键 C.配位键 D.氢键 E. 键 F.
键 F. 键
键
(3)Ni、Co的第五电离能: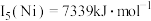 ,
,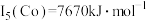 ,
,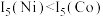 ,其原因是
,其原因是___________ 。
(4)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是___________ 。
(5)硒化锌晶胞结构如图所示,其晶 胞参数为a pm。
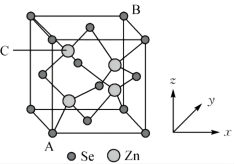
①相邻的 与
与 之间的距离为
之间的距离为___________ pm。
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标___________ 。
③若硒化锌晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________ (用含a、 的计算式表示)。
的计算式表示)。
(1)基态Cu原子的价电子排布
(2)镍的氨合离子
 中存在的化学键有
中存在的化学键有A.离子键 B.共价键 C.配位键 D.氢键 E.
 键 F.
键 F. 键
键(3)Ni、Co的第五电离能:
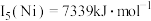 ,
,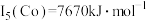 ,
,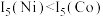 ,其原因是
,其原因是(4)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是
(5)硒化锌晶胞结构如图所示,其晶 胞参数为a pm。

①相邻的
 与
与 之间的距离为
之间的距离为②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标
③若硒化锌晶体的密度为
 ,则阿伏加德罗常数
,则阿伏加德罗常数
 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
2021-03-14更新
|
2011次组卷
|
11卷引用:山东省新泰市第一中学2020-2021学年高二下学期第一次阶段性考试化学试题
山东省新泰市第一中学2020-2021学年高二下学期第一次阶段性考试化学试题山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题山东省泰安市宁阳县第四中学2021-2022学年高二下学期第一次段考化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题山东省菏泽市2021届高三下学期3月第一次模拟考试化学试题山东省菏泽市2021届高考第一次模拟考试化学试题(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】四川省成都市树德中学2023-2024学年高三上学期10月阶段性测试理科综合化学试题(已下线)结构与性质天津经济技术开发区第一中学(泰达一中)2023-2024学年高三上学期期中考试化学试卷



