1 . 下列有关电子云和原子轨道的说法正确的是( )
| A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 |
| B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动 |
| C.与s电子原子轨道相同,p电子原子轨道的平均半径也随能层的增大而增大 |
| D.基态原子电子能量的高低顺序为: E(1s)<E(2s)<E(2px)<E(2py)<E(2pz) |
您最近一年使用:0次
名校
2 . 下列各项叙述中正确的是 ( )
| A.电子层序数越大,s原子轨道的形状相同,半径越大 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 |
| D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
您最近一年使用:0次
2019-06-14更新
|
1023次组卷
|
16卷引用:四川省西昌市2020-2021学年高二下学期期中检测化学试题
四川省西昌市2020-2021学年高二下学期期中检测化学试题2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆昌吉教育共同体2020-2021学年高二下学期期中考试化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期7月期末化学试题
3 . 下列有关电子云和原子轨道的说法正确的是( )
| A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云 |
| B.量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道 |
| C.s 能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动 |
| D.p 能级的原子轨道呈纺锤形,随着电子层数的增加,p 能级原子轨道也在增多 |
您最近一年使用:0次
2019-06-11更新
|
170次组卷
|
3卷引用:四川省安岳县兴隆中学2021-2022学年高二上学期期中测试化学试题
4 . 下列有关说法正确的是
| A.每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高 |
| B.原子核外电子云是核外电子运动后留下的痕迹 |
| C.教材中说“核外电子的概率密度分布看起来像一片云雾,因为被形象地称作电子云”,这说明原子核外电子云是实际存在的 |
| D.每个能层都有P能级,P能级都有3个原子轨道 |
您最近一年使用:0次
2019-04-26更新
|
234次组卷
|
3卷引用:【校级联考】四川省蓉城名校联盟2018-2019学年高二下学期期中考试化学试题
5 . 如图是s能级和p能级的电子云轮廓图,试回答问题。
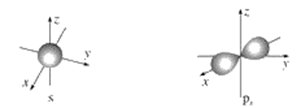
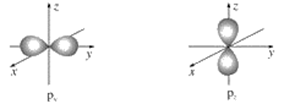
(1)s电子云轮廓图呈________ 形,每个s能级有________ 个原子轨道;p电子云轮廓图呈________ 状,每个p能级有________ 个原子轨道,其能量关系为____________ (填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnnpn+1,原子中能量最高的是________ 电子;元素X的名称是____ ,它的氢化物的电子式是________ 。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________ ,原子的电子排布图为______________________________ 。
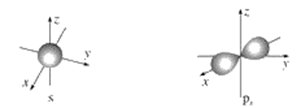
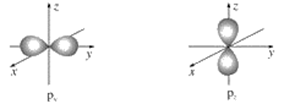
(1)s电子云轮廓图呈
(2)元素X的原子最外层的电子排布式为nsnnpn+1,原子中能量最高的是
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为
您最近一年使用:0次
2019-01-11更新
|
267次组卷
|
4卷引用:四川省巴中市平昌县驷马中学2020-2021学年高二上学期期末测试化学试题
解题方法
6 . 镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________ ,未成对电子数为________________ 。
(2)Ga(NO3)3中阴离子的立体构型是_____________ ,写出一个与该阴离子的立体构型相同的分子的化学式___________ 。
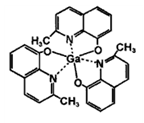
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________ (填元素符号),提供孤电子对的成键原子是_____________ 。
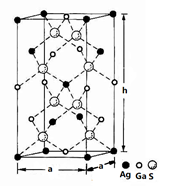
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________ ,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________ g·cm-3(列出计算式即可)。
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为
(2)Ga(NO3)3中阴离子的立体构型是
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是

(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为

您最近一年使用:0次
2018-04-28更新
|
347次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2020届高三上学期期末考试理综化学试题
名校
解题方法
7 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
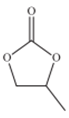
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
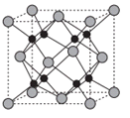
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:四川省棠湖中学2020届高三上学期期末考试理综化学试题
名校
8 . X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子核外有___________ 种不同运动状态的电子;
Z所在周期中第一电离能最大的主族元素是____ (写元素名称)。
(2)离子X Y-的立体构型是_____ ;,X2M2分子中X原子的杂化方式是______ ,1 molX2M2含有___________ 个σ键;
(3)向RZO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为_____ 色。反应过程中涉及的离子方程式为:______________________ 、__________________________ 。
(4) 从核外电子排布角度解释高温下R2O比RO更稳定的原因_____________________________
(5)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是_______________________________________________ 。
(6)如图表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见如图),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是____ (填字母)。
a.CF4 b.CH4 c.NH4+ d.H2O
(1)基态Y原子核外有
Z所在周期中第一电离能最大的主族元素是
(2)离子X Y-的立体构型是
(3)向RZO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为
(4) 从核外电子排布角度解释高温下R2O比RO更稳定的原因
(5)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是
(6)如图表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见如图),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
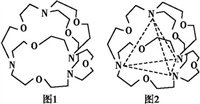
a.CF4 b.CH4 c.NH4+ d.H2O
您最近一年使用:0次
真题
名校
9 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______ nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________ ,占据该能层电子的电子云轮廓图形状为___________ 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________ 。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________ ,中心原子的杂化形式为________________ 。
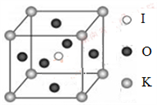
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______ nm,与K紧邻的O个数为__________ 。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______ 位置,O处于______ 位置。
 .
.
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于
 .
.
您最近一年使用:0次
2017-08-09更新
|
8943次组卷
|
22卷引用:四川省成都实验中学2019-2020学年度高三上学期1月月考理科综合化学试题
四川省成都实验中学2019-2020学年度高三上学期1月月考理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)(已下线)【中等生百日捷进提升系列-基础练测】专题2.17 物质结构与性质(已下线)【艺体生文化课百题突围系列-基础练测】专题2.17 物质结构与性质(选修)(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题12 物质结构与性质应试策略云南省富宁县民族中学2020届高三上学期开学考试化学试题第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题广东省梅州市五华县2018-2019学年高二上学期第六次质量监测化学试题河北省衡水中学2020届高三四月份质量监测理综化学试题(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题云南省富宁县第一中学校2021-2022学年高三下学期开学考试理综化学试题
9-10高二下·辽宁大连·期末
名校
10 . 下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是
| A.BeCl2 | B.PCl3 | C.PCl5 | D.N2 |
您最近一年使用:0次
2017-06-09更新
|
279次组卷
|
9卷引用:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷
(已下线)2011--2012学年四川省成都二十中高二上学期期中考试化学试卷(已下线)2012-2013学年四川省南充高中高二上学期期中考试文科化学试卷(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)2012年人教版高中化学选修3 2.3分子的性质练习卷(已下线)2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题上海交通大学附属中学2017-2018学年高一上学期末考化学试题山西省忻州市第二中学2019-2020高二下学期3月考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)



