22-23高三上·辽宁·阶段练习
解题方法
1 . 下列化学用语或图示表达正确的是
A.HCl分子中σ键的电子云轮廓图: |
B.自由基 的电子式: 的电子式: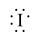 |
C.反-2-丁烯的分子结构模型: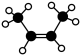 |
D.脱氧核糖的结构简式: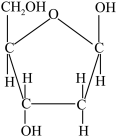 |
您最近一年使用:0次
22-23高三上·湖北·阶段练习
2 . 超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。现有某种超分子结构如图所示。下列有关说法正确的是
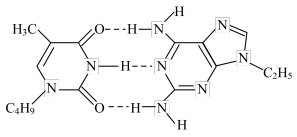

| A.该超分子中N原子核外电子有7种空间运动状态 |
| B.该超分子中存在的作用力有:极性键、非极性键、氢键、配位键 |
C.该超分子中甲基的键角∠HCH小于-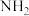 的键角∠HNH 的键角∠HNH |
| D.该超分子既可与酸反应,又可与碱反应 |
您最近一年使用:0次
名校
解题方法
3 . 下列化学用语或图示表达不正确的是
A.原子核内中子数为20的氯原子: | B.H2O的VSEPR模型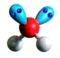 |
C.二氧化碳的电子式: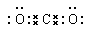 | D.p-pπ键电子云轮廓图 |
您最近一年使用:0次
2022-11-03更新
|
365次组卷
|
3卷引用:北京市第一六一中学2022-2023学年高三上学期期中考试化学试题
2022·上海虹口·二模
名校
解题方法
4 . 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、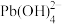 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,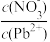
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、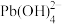 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
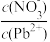
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
您最近一年使用:0次
2022-05-29更新
|
272次组卷
|
4卷引用:2022年北京高考真题变式题1-14
(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)上海市虹口区2022届高三下学期第二次模拟考试化学试题江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题
5 . 周期表中前20种元素X、Y、Z、W原子序数依次增大,它们的结构性质等信息如下表所述:
请根据信息回答有关问题:
(1)元素X的原子核外共有_______ 种不同运动状态的电子,其基态原子中最高能级的电子云轮廓图形状是_______ 。
(2)Y的核外电子轨道表示式是_______ ,其价层电子的电子云在空间有_______ 种伸展方向。
(3)由X原子构成的共价晶体的名称是_______ ,晶体中X原子的杂化形式是_______ 。
(4)由Z和Y形成YZ3分子的电子式为_______ ,是_______ (填“极性”或“非极性”)分子。
| 元素 | 结构性质等信息 |
| X | 基态原子有三个能级,每个能级上的电子数都相等 |
| Y | 该元素原子价层电子排布式为nsnnpn+1 |
| Z | 常温常压下,该元素构成的单质是一种有毒的黄绿色气体 |
(1)元素X的原子核外共有
(2)Y的核外电子轨道表示式是
(3)由X原子构成的共价晶体的名称是
(4)由Z和Y形成YZ3分子的电子式为
您最近一年使用:0次
名校
解题方法
6 . 下列图示正确的是
A.3p电子的电子云轮廓图: |
B.SO3的VSEPR模型: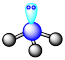 |
C.As的原子结构示意图: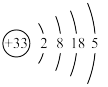 |
D.HCl的形成过程: |
您最近一年使用:0次
2022-05-08更新
|
799次组卷
|
6卷引用:北京市西城区2022届高三第二次模拟测试化学试题
北京市西城区2022届高三第二次模拟测试化学试题(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题北京市第八中学2023-2024学年高三上学期期中练习化学试题北京市第一七一中学2023-2024学年高三上学期12月月考化学试题 北京市第一六一中学2023-2024学年高三上学期开学考化学试卷 2024届天津市宁河区芦台第一中学高三下学期第三次模拟化学试题
名校
7 . 氯元素有多种化合价,可形成多种离子。下列说法错误的是
| A.基态Cl原子核外电子的空间运动状态有9种 |
B.键角: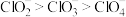 |
C. 提供孤电子对与 提供孤电子对与 可形成 可形成 |
D. 、 、 、 、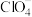 中Cl的杂化方式相同 中Cl的杂化方式相同 |
您最近一年使用:0次
解题方法
8 . 人类对原子结构的认识经历了一个漫长的、不断深化的过程。下列说法错误的是
| A.1803年,英国化学家道尔顿提出了原子论,他认为原子是不可被分割的 |
| B.1904年,汤姆孙提出了原子结构的“葡萄干布丁”模型 |
| C.1911年,卢瑟福根据a粒子散射实验提出了原子结构的核式模型 |
| D.1913年,波尔根据原子光谱实验建立了核外电子分层排布的原子结构模型,他认为在不同轨道上运动的电子具有相同的能量,能量值是连续的 |
您最近一年使用:0次
2022-05-04更新
|
264次组卷
|
3卷引用:北京市房山区2021-2022学年高二下学期期中考试化学试题
北京市房山区2021-2022学年高二下学期期中考试化学试题福建省福清西山学校2021-2022学年高二下学期5月月考化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
9 . 工业上用Fe(Ⅲ)作为可再生氧化剂回收工业废气中的H2S,生产单质硫。
(1)铁元素属于_______ 区(填“s”、“d”、“ds”、“p”)。
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是_______ 。
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。_______
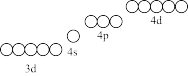
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式_______ 。
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式_______ 。
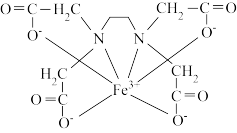
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有_______ mol。
(1)铁元素属于
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。
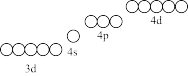
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有

您最近一年使用:0次
2022-04-02更新
|
385次组卷
|
2卷引用:北京市石景山区2022届高三一模化学试题
名校
解题方法
10 . 下列化学用语或图示表达正确的是
A.NaCl的电子式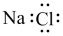 | B.SO2的VSEPR模型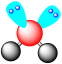 |
C.p—pσ键电子云轮廓图 | D. 的空间结构模型 的空间结构模型 |
您最近一年使用:0次
2022-01-17更新
|
514次组卷
|
7卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题



