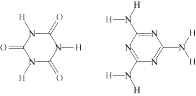
锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、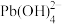 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,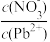
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、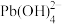 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
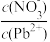
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
2022·上海虹口·二模 查看更多[4]
江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题(已下线)2022年北京高考真题化学试题变式题(结构与性质)(已下线)2022年北京高考真题变式题1-14上海市虹口区2022届高三下学期第二次模拟考试化学试题
更新时间:2022-05-29 13:42:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
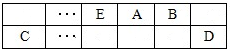
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为____________ 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a____ b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:_______________ 填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:________________ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________ 。
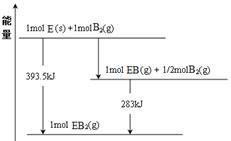
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________ 。

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为_________________ 。

(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式


(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________ ,反应的化学方程式为______________ 。
(2)完成下表实验过程:
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O 转变为SO
转变为SO ,设计实验验证该预测:取少量反应后的溶液于试管中,
,设计实验验证该预测:取少量反应后的溶液于试管中,______________ 。

(1)装置A的作用是制备
(2)完成下表实验过程:
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2= Na2SO3+CO2 2Na2S+3SO2= 2Na2SO3+3S↓ Na2SO3+S = Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
 转变为SO
转变为SO ,设计实验验证该预测:取少量反应后的溶液于试管中,
,设计实验验证该预测:取少量反应后的溶液于试管中,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】电子工业中,可用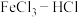 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
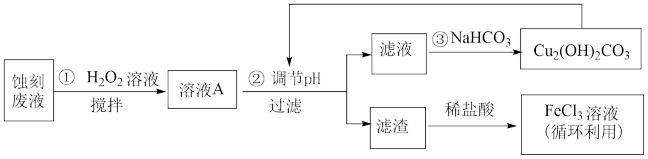
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的pH如下表。
根据表中数据推测调节pH的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在25℃下,向浓度均为 的
的 溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤
溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤ )时溶液的pH为
)时溶液的pH为___________ (已知25℃时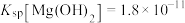 )。
)。
 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的pH如下表。
 |  |  | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在25℃下,向浓度均为
 的
的 溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤
溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤ )时溶液的pH为
)时溶液的pH为 )。
)。
您最近一年使用:0次
【推荐1】磷酸亚铁锂( )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:
(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为________ 形。
(2)Fe元素位于周期表_____ 周期_____ 族;原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为___________ 。
(3)基态Mn2+的价电子排布式为___________ ,锰的第三电离能高于铁的第三电离能,其原因是___________ 。
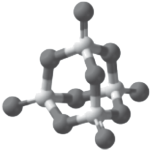
(4)P4S10的分子结构如图所示,其中含有________ 个六元环;______ g P4S10含有8molσ键。
 )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为
(2)Fe元素位于周期表
 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为(3)基态Mn2+的价电子排布式为
(4)P4S10的分子结构如图所示,其中含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国科学家研究的第五代甲醇生产技术被誉为“液态阳光”,该技术中水经过太阳能光解制得氢气,再利用二氧化碳催化加氢合成甲醇。回答下列问题:
(1)硫化氢分子和水分子结构相似,但冰中水分子周围紧邻的分子数(4个)远小于硫化氢的(12个),原因是____ 。
(2)二氧化碳是重要的碳源,1molCO2分子中存在____ 个π键,碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式:____ 。基态氧原子有_____ 种不同形状的电子云。
(3)磷化硼纳米颗粒可以作为CO2合成甲醇时的非金属电催化剂,磷化硼硬度极大,在数千摄氏度高温时也较稳定,其立方晶胞结构如图所示。回答下列问题:

①晶胞中含有的P原子与B原子的个数比为____ ,晶体中与P原子距离最近且相等的P原子数为____ 。
②已知阿伏加德罗常数的值为NA,磷化硼的晶胞参数为apm,磷化硼晶体的密度ρ=____ g·cm-3。
(1)硫化氢分子和水分子结构相似,但冰中水分子周围紧邻的分子数(4个)远小于硫化氢的(12个),原因是
(2)二氧化碳是重要的碳源,1molCO2分子中存在
(3)磷化硼纳米颗粒可以作为CO2合成甲醇时的非金属电催化剂,磷化硼硬度极大,在数千摄氏度高温时也较稳定,其立方晶胞结构如图所示。回答下列问题:

①晶胞中含有的P原子与B原子的个数比为
②已知阿伏加德罗常数的值为NA,磷化硼的晶胞参数为apm,磷化硼晶体的密度ρ=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】重晶石( )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
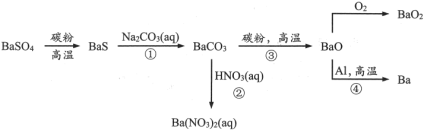
完成下列填空:
(1)Ba在元素周期表中位于第_______ 族,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素原子半径由大到小的顺序是_______ ,可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(2)配平BaS与稀硝酸反应的化学方程式:_______ 。
_______ _______
_______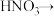 _______
_______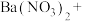 _______
_______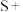 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入_______ (填试剂),有黑色沉淀生成,则BaS未反应完全。
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制 的原因是
的原因是_______ 。
(4)元素的金属性:Al_______ Ba(选填“>”或“<”);已知:沸点Al>Ba,反应④在真空容器中可以发生的理由是_______ 。
 )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第
(2)配平BaS与稀硝酸反应的化学方程式:
_______
 _______
_______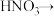 _______
_______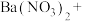 _______
_______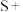 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制
 的原因是
的原因是(4)元素的金属性:Al
您最近一年使用:0次
【推荐1】A、B、C、D、E、F是元素周期表前四周期中的常见元素,其原子序数依次增大。A元素的一种核素的质量数是14,中子数是8;B元素基态原子的最外层有3个未成对电子,次外层有2个电子;C是地壳中含量最多的一种元素;D元素基态原子核外9个原子轨道上填充了电子且有1个未成对电子;E是一种常见的金属元素,可形成多种氧化物,其中一种氧化物是具有磁性的黑色物质;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。请完成以下空白:
(1)D元素的基态原子中,核外电子占据的最高能层的符号为___________ 。
(2)B元素的基态原子价层电子排布图为___________ 。
(3)请解释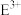 离子比
离子比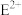 离子稳定的原因
离子稳定的原因___________ 。
(4)基态F二价阳离子的核外电子排布式为___________ 。
(5)A、B、C三种元素的第一电离能从大到小为___________ (用元素符号表示)。
(1)D元素的基态原子中,核外电子占据的最高能层的符号为
(2)B元素的基态原子价层电子排布图为
(3)请解释
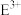 离子比
离子比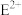 离子稳定的原因
离子稳定的原因(4)基态F二价阳离子的核外电子排布式为
(5)A、B、C三种元素的第一电离能从大到小为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)LiGaH4是一种温和的还原剂,其可由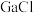 3和过量的LiH反应制得:
3和过量的LiH反应制得: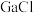 3
3 4
4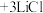 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③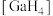 -的立体构型为
-的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示
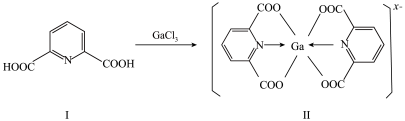
①化合物I中环上N原子的杂化方式为_______ ,1mol化合物Ⅰ中含有的σ键的物质的量为_______ 。化合物I中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:
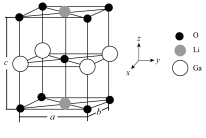
①上述晶胞沿着a轴的投影图为_______ (填选项字母)。
A.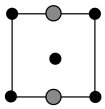 B.
B.  C.
C.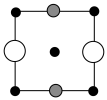
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由
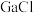 3和过量的LiH反应制得:
3和过量的LiH反应制得: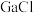 3
3 4
4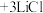 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
③
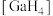 -的立体构型为
-的立体构型为(3)一种含镓的药物合成方法如图所示

①化合物I中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B.  C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】下表为四种短周期元素的相关信息
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素的最简单氢化物的空间构型是___________ 。
(2)最高价的R与Z元素组成的化合物中R原子的杂化方式为___________ ,其中R在周期表中的位置是___________ ,R的基态原子电子排布式为___________ 。
(3)Z、Q、R相比,其原子半径由大到小的顺序是___________ 。
(4)与O3分子互为等电子体的一种分子为___________ ,阴离子为___________ 。
(5)Y与R相比,非金属性较强的是___________ ,能证明这一结论的事实是___________ 。(用化学方程式表示)
| 元素 | 元素的相关信息 |
| Y | 原子最外层电子数是次外层电子数的2倍 |
| Z | 地壳中含量最多的元素 |
| Q | 短周期中金属性最强 |
| R | 常温下,R的单质是淡黄色固体,常在火山喷口附近沉积 |
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素的最简单氢化物的空间构型是
(2)最高价的R与Z元素组成的化合物中R原子的杂化方式为
(3)Z、Q、R相比,其原子半径由大到小的顺序是
(4)与O3分子互为等电子体的一种分子为
(5)Y与R相比,非金属性较强的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、P、Q、W、R、T是元素周期表短周期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
(1)W元素在周期表的位置_____ ;T离子的结构示意图为____ 。
(2)将Q、Z、R的简单离子的半径从大到小排序____ (用离子符号表示);
R、T两种元素的最高价氧化物对应水化物的酸性较强的是____ (用化学式表示)。
(3)X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为____ ;化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为____ 。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”…等)。
(5)分别写出Y、R最高价氧化物对应水化物的化学式____ 、____ ,铜能和这两种物质的浓溶液发生反应,请写出两个反应的化学方程式:_____ ;___________ ;
(6)P和Z能形成一种白色的固体,请用电子式表示该物质的形成过程:______ ;
| 元素 | 相关信息 |
| X | 其某一种同位素,被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25、中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(2)将Q、Z、R的简单离子的半径从大到小排序
R、T两种元素的最高价氧化物对应水化物的酸性较强的是
(3)X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”…等)。
| 化合物 | X3Y4 | R2T2 |
| 主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600°C | 常温下是一种橙黄色液体,熔点为﹣76°C |
| 晶体类型 |
(6)P和Z能形成一种白色的固体,请用电子式表示该物质的形成过程:
您最近一年使用:0次
【推荐2】(1)写出碳原子最外电子层的轨道表示式___ 。
(2)钛(Ti)是22号元素,它是___ (选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为____ ;其熔沸点比CO2高的原因是___ 。
(4)氟化钠溶液中,不存在的微粒间作用力是___ (填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为_____ 。
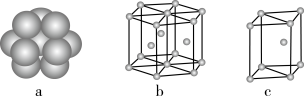
(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的___ (填a、b或c);配位数是____ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg•cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是__ 。
(2)钛(Ti)是22号元素,它是
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为
(4)氟化钠溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为

(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的
您最近一年使用:0次