1 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主族元素的基态原子中第一电离能最大。下列说法错误的是
| A.与X同主族的元素的基态原子最外层电子所占轨道呈球形 |
| B.Y、Z、W均位于元素周期表的p区 |
| C.Z与W可形成多种化合物 |
| D.Z的最高价氧化物对应的水化物为强酸 |
您最近一年使用:0次
2021-12-10更新
|
680次组卷
|
6卷引用:山东省2020年届高考全真模拟(泰安三模)化学试题
山东省2020年届高考全真模拟(泰安三模)化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题山东省日照市莒县、五莲县、岚山区2021-2022学年高二11月联合考试化学试题(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
2 . 下列对化学用语的叙述正确的是
| A.碳原子最外层电子云有三种不同的伸展方向 | B.CCl4的比例模型: |
C.氮分子的结构式: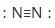 | D.溴化铵的电子式: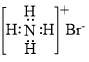 |
您最近一年使用:0次
2021-10-03更新
|
363次组卷
|
3卷引用:上海交通大学附属中学2020-2021学年高三上学期第一次月考化学试题
12-13高二下·山东济南·期中
名校
3 . 玻尔理论、量子力学理论都是对核外电子运动状态的描述,根据对它们的理解,判断下列叙述正确的是
| A.因为s轨道的形状是球形的,所以s电子做圆周运动 |
| B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 |
| C.在同一能级上运动的电子,其运动状态肯定相同 |
| D.原子轨道和电子云都是用来形象地描述电子运动状态的 |
您最近一年使用:0次
2021-02-16更新
|
331次组卷
|
7卷引用:2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷
(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷河南省信阳市2016-2017学年高二下学期期中考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第37练 原子结构-2023年高考化学一轮复习小题多维练(全国通用)(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第1节 原子结构模型河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
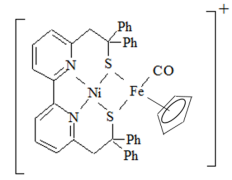
4 . (1)Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(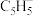 ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为______ ,配合物离子中铁周围的价电子数共有______ 个,S元素的杂化方式为______ ,该配合物离子中的 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为______ (用Ⅰ或Ⅱ表示)。
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为______ 。基态Cs原子中电子占据的能量最高的轨道是______ ,能量最低的空轨道是______ 。
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(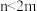 ),则可以形成大π键,表示为
),则可以形成大π键,表示为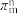 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为______ 。
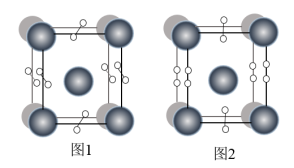
(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有______ 种。若K之间底面上的最近距离为a pm,竖直方向上为c pm,图2表示的晶体密度为______  ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
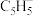 ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(
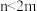 ),则可以形成大π键,表示为
),则可以形成大π键,表示为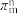 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有
 ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
您最近一年使用:0次
2021-01-03更新
|
576次组卷
|
4卷引用:八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)
八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题
20-21高二上·四川内江·阶段练习
名校
解题方法
5 . 下列关于原子结构、原子轨道的说法正确的是
| A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子 |
| B.在K能层中,有自旋相反的两条轨道 |
| C.s电子绕核运动,其轨道为球面,而p电子在纺锤形曲面上运动 |
| D.电子云通常是用小黑点来表示电子的多少 |
您最近一年使用:0次
2020-10-29更新
|
908次组卷
|
8卷引用:第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题(已下线)练习11 原子结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)第1讲 原子结构 核外电子排布(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
20-21高三上·江苏南通·阶段练习
名校
解题方法
6 . 短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y的基态原子中含11种运动状态不同的电子, Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是
| A.原子的半径:r(X)<r(Y)<r(Z)<r(W) |
| B.X与Y组成的化合物中均不含共价键 |
| C.简单气态氢化物的沸点X的比Z的高 |
| D.由X、Y、W三种元素组成的化合物的水溶液一定呈碱性 |
您最近一年使用:0次
2020-10-15更新
|
168次组卷
|
3卷引用:江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题
(已下线)江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题江苏省南京市第十三中学2021届高三上学期教学质量调研(一)化学试题江苏省镇江第一中学2020-2021学年高二下学期阶段性检测化学试题
名校
7 . 铋(83Bi)为第V A族元素,常见化合价为+3和+5。化合物NaBiO3为黄色固体,常温下微溶于水,在空气中逐渐分解产生Bi2O3、NaOH等物质。
(1)铋元素最外层电子分布在_____ 种能级中,共有_____ 种运动状态。
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为_________ 。
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:_______ 。
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是______ 。
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
______ NaBiO3+______ MnSO4+______ H2SO4→______ Na2SO4+______ Bi2(SO4)3+______ NaMnO4+______ H2O
②若有2mol氧化剂在该反应中被还原,则生成的MnO 被还原为Mn2+时,能将
被还原为Mn2+时,能将____ mol HCl氧化成Cl2。
(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:_________ 。
(1)铋元素最外层电子分布在
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
②若有2mol氧化剂在该反应中被还原,则生成的MnO
 被还原为Mn2+时,能将
被还原为Mn2+时,能将(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
8 . 下列说法正确的是( )
| A.电子在原子核外排布时,总是尽量先排在能量最低的电子层上 |
B.单核离子最外层电子数一定满足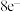 或 或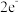 的稳定结构 的稳定结构 |
| C.元素的性质随着元素相对原子质量的递增而呈周期性变化的规律叫元素周期律 |
| D.周期表中元素种类最多的族是VⅢ族,VⅢ族有三个纵行 |
您最近一年使用:0次
2020-08-30更新
|
332次组卷
|
3卷引用:浙江省名校新高考研究联盟(Z20联盟)2020届高三第三次联考化学试题
9 . (1)写出碳原子最外电子层的轨道表示式___ 。
(2)钛(Ti)是22号元素,它是___ (选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为____ ;其熔沸点比CO2高的原因是___ 。
(4)氟化钠溶液中,不存在的微粒间作用力是___ (填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为_____ 。
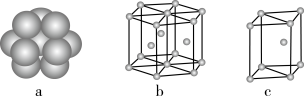
(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的___ (填a、b或c);配位数是____ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg•cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是__ 。
(2)钛(Ti)是22号元素,它是
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为
(4)氟化钠溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为

(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的
您最近一年使用:0次
10 . 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。下列有关电子云的说法正确的是
| A.概率密度的大小体现了电子数目的多少 |
| B.概率密度的大小体现了空间某处电子出现概率的大小 |
| C.基态C原子的1s电子的电子云和2s电子的电子云完全相同 |
| D.基态Li原子的1s电子的电子云和2s电子的电子云形状不同 |
您最近一年使用:0次
2020-07-07更新
|
311次组卷
|
4卷引用:陕西省咸阳百灵学校2019-2020学年高二下学期第二次月考化学试题



