解题方法
1 . 在元素周期表的一百多种化学元素中,非金属元素仅有24种,但在社会生活中占有着重要的位置。
(1)根据元素周期表的分区,非金属元素分布在元素周期表的__________ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用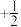 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的磷原子,其核外电子占据的最高能层符号为
表示,称为电子的自旋磁量子数。对于基态的磷原子,其核外电子占据的最高能层符号为__________ ,自旋磁量子数的代数和为__________ 。
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示。试分析碳元素的
变化趋势如图所示。试分析碳元素的 大于氮元素的
大于氮元素的 的原因
的原因__________ 。

(4)写出一种与 互为等电子体的一种分子的化学式:
互为等电子体的一种分子的化学式:__________ 。
(5)乙醇( )能与水以任意比例互溶,但与其结构相似的乙硫醇(
)能与水以任意比例互溶,但与其结构相似的乙硫醇(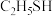 )微溶于水,原因是
)微溶于水,原因是__________ 。
(6)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则与苯分子具有相似结构的吡啶(
键的电子数,则与苯分子具有相似结构的吡啶(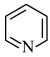 )中的大
)中的大 键应表示为
键应表示为__________ 。
(7)由两种不同的卤素组成的化合物叫卤素互化物(如BrCl等),其性质与卤素单质相似。试写出BrCl与水发生反应的化学方程式:__________ 。
(1)根据元素周期表的分区,非金属元素分布在元素周期表的
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
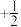 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的磷原子,其核外电子占据的最高能层符号为
表示,称为电子的自旋磁量子数。对于基态的磷原子,其核外电子占据的最高能层符号为(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示。试分析碳元素的
变化趋势如图所示。试分析碳元素的 大于氮元素的
大于氮元素的 的原因
的原因
(4)写出一种与
 互为等电子体的一种分子的化学式:
互为等电子体的一种分子的化学式:(5)乙醇(
 )能与水以任意比例互溶,但与其结构相似的乙硫醇(
)能与水以任意比例互溶,但与其结构相似的乙硫醇(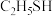 )微溶于水,原因是
)微溶于水,原因是(6)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则与苯分子具有相似结构的吡啶(
键的电子数,则与苯分子具有相似结构的吡啶( )中的大
)中的大 键应表示为
键应表示为(7)由两种不同的卤素组成的化合物叫卤素互化物(如BrCl等),其性质与卤素单质相似。试写出BrCl与水发生反应的化学方程式:
您最近一年使用:0次
2024-04-08更新
|
65次组卷
|
2卷引用:河南省南阳市六校联考2023-2024学年高二下学期3月月考化学试卷
名校
2 . 回答下列问题
(1)基态S原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3) 成为阳离子时首先失去
成为阳离子时首先失去___________ 轨道电子, 的价层电子排布式
的价层电子排布式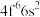 ,
,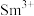 价层电子排布式为
价层电子排布式为___________ 。
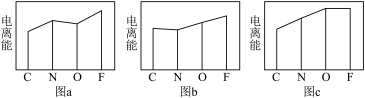
(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填标号),第三电离能的变化图是___________ (填标号)。
(5)氟原子激发态的电子排布式有___________ ,其中能量较高的是___________ 。(填标号)
a、 b、
b、 c、
c、 d、
d、
(6)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为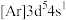
B.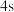 电子能量较高,总是在比
电子能量较高,总是在比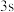 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(7)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
(8)H、B、N中,原子半径最大的是___________ 。根据对角线规则,B的一些化学性质与元素___________ 的相似。
(9)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)
 成为阳离子时首先失去
成为阳离子时首先失去 的价层电子排布式
的价层电子排布式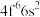 ,
,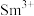 价层电子排布式为
价层电子排布式为(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(5)氟原子激发态的电子排布式有
a、
 b、
b、 c、
c、 d、
d、
(6)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为
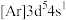
B.
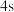 电子能量较高,总是在比
电子能量较高,总是在比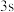 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
(7)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(8)H、B、N中,原子半径最大的是
(9)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.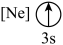 | B.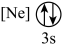 | C.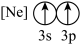 | D.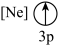 |
您最近一年使用:0次
3 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)X原子的结构示意图为:___________ ,其核外电子运动状态共有___________ 种,Z的基态原子的价电子排布式为___________ 。
(2)写出M与R形成含有非极性键的离子化合物的电子式___________ 。
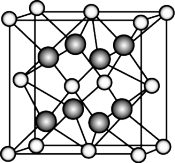
(3)M和R所形成的一种离子化合物晶体的晶胞如图所示,则该离子化合物的化学式是___________ ,该物质与水反应的化学方程式为:___________ 。
(4)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是___________ 。
(1)X原子的结构示意图为:
(2)写出M与R形成含有非极性键的离子化合物的电子式
(3)M和R所形成的一种离子化合物晶体的晶胞如图所示,则该离子化合物的化学式是

(4)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是
您最近一年使用:0次
4 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)写出A的元素符号____ ,D的元素名称____ 。
(2)B基态原子中能量最高的电子,其电子云在空间有____ 个方向,原子轨道呈____ 形。
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了____ 。
(4)E元素原子核外有____ 种运动状态不同的电子。
(5)G位于____ 族____ 区,价电子排布式为____ 。
(6)检验F元素的方法是____ ,请用原子结构的知识解释产生此现象的原因是____ 。
| A元素原子半径在元素周期表中最小,也是宇宙中最丰富的元素 |
| B元素原子的核外p能级总电子数比s能级总电子数少1个 |
| C元素原子的第一至第四电离能分别是I1=738kJ·mol-1;I2=l451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4,原子半径同周期最小 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(4)E元素原子核外有
(5)G位于
(6)检验F元素的方法是
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素在元素周期表中的位置为____ ,基态Cu原子核外有___ 种不同运动状态的电子。
(2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。

①M所含元素的电负性由大到小的顺序为____ (用元素符号表示)。
②X中采用sp3杂化的非金属原子有___ (填元素名称)。
③分子中的大Π键可用符号Π 表示,其中m为参与形成大Π键的原子数,n代表参与形成大Π键的电子数,则苯分子中的大π键表示为
表示,其中m为参与形成大Π键的原子数,n代表参与形成大Π键的电子数,则苯分子中的大π键表示为____ 。
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是___ ,Y的沸点比水低的主要原因是____ 。
(4)向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O____ NH3(填“大于”或“小于”)。
(1)铜元素在元素周期表中的位置为
(2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。

①M所含元素的电负性由大到小的顺序为
②X中采用sp3杂化的非金属原子有
③分子中的大Π键可用符号Π
 表示,其中m为参与形成大Π键的原子数,n代表参与形成大Π键的电子数,则苯分子中的大π键表示为
表示,其中m为参与形成大Π键的原子数,n代表参与形成大Π键的电子数,则苯分子中的大π键表示为(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是
(4)向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O
您最近一年使用:0次
6 . (1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理___________ ,哪些违反了洪特规则___________ 。
(2)在H-S、H-Cl两种共价键中,键的极性较强的是___________ (填“H-Cl”或“H-S”), 与
与 的结构相似,和过渡金属更容易形成配合物的是
的结构相似,和过渡金属更容易形成配合物的是___________ (填“ ”或“
”或“ ”)。
”)。
①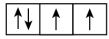 ②
②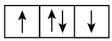 ③
③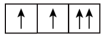 ④
④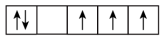 ⑤
⑤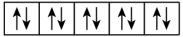 ⑥
⑥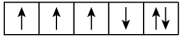
(2)在H-S、H-Cl两种共价键中,键的极性较强的是
 与
与 的结构相似,和过渡金属更容易形成配合物的是
的结构相似,和过渡金属更容易形成配合物的是 ”或“
”或“ ”)。
”)。①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
您最近一年使用:0次
7 . 现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式___________ ;
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈_________ 形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为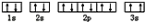 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了___________ ;
(4)G位于____ 族__ 区,价电子排布式为___________ ;
(5)DE3中心原子的杂化方式为___________ ,用价层电子对互斥理论推测其空间构型为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kT/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为
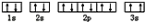 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(4)G位于
(5)DE3中心原子的杂化方式为
您最近一年使用:0次
解题方法
8 . (1)X射线衍射测定等发现,I3AsF6中存在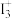 离子。
离子。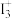 离子中心原子的杂化形式为
离子中心原子的杂化形式为_______ 。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm晶胞中Fe2+位于S 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为_______ nm。

(3)在周期表中,与Li的化学性质最相似的邻族元素是_______ ,该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”)。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为_______ ,其中Fe的配位数为_______ 。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
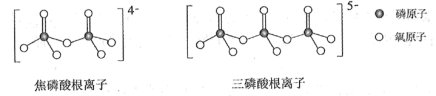
这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
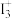 离子。
离子。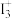 离子中心原子的杂化形式为
离子中心原子的杂化形式为(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm晶胞中Fe2+位于S
 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
(3)在周期表中,与Li的化学性质最相似的邻族元素是
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
解题方法
9 . 现有A、B、C、D、E、F、G、H8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)C2A4的电子式为__ 。(A、C为字母代号,请将字母代号用元素符号表示,下同)。
(2)B元素的原子核外共有__ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈__ 形。
(3)某同学推断E元素基态原子的核外电子轨道表示式为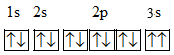 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了__ ,该元素的I3远远大于I2,其原因是__ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是__ 。
(5)H位于元素周期表中__ 区(按电子排布分区),其基态原子的价电子排布式为__ 。实验室用一种黄色溶液检验H2+时产生蓝色沉淀,该反应的离子方程式为__ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
| E元素的气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)H位于元素周期表中
您最近一年使用:0次
10 . 现有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为
的电子式为___________ 。(A、C为字母代号,请将字母代号用元素符号表示,下同)
(2) 元素的原子核外共有
元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断 元素基态原子的核外电子轨道表示式为
元素基态原子的核外电子轨道表示式为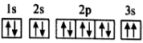 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了___________ ,该元素原子的 远远大于
远远大于 ,其原因是
,其原因是___________ 。
(4) 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是___________ 。
(5) 位于元素周期表中
位于元素周期表中___________ 区(按电子排布分区),其基态原子的价层电子排布式为___________ ,实验室用一种黄色溶液检验 时产生蓝色沉淀该反应的离子方程式为
时产生蓝色沉淀该反应的离子方程式为___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
 元素是形成化合物种类最多的元素 元素是形成化合物种类最多的元素 |
 元素基态原子的核外 元素基态原子的核外 能级电子数比 能级电子数比 能级电子数少1个 能级电子数少1个 |
 元素基态原子的核外 元素基态原子的核外 轨道中有两个未成对电子 轨道中有两个未成对电子 |
 元素的气态基态原子的第一至第四电离能分别是 元素的气态基态原子的第一至第四电离能分别是 , , , , , ,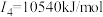 |
 元素的主族序数与周期数的差为4 元素的主族序数与周期数的差为4 |
 元素是前四周期中电负性最小的元素 元素是前四周期中电负性最小的元素 |
 元素位于元素周期表中的第8列 元素位于元素周期表中的第8列 |
 的电子式为
的电子式为(2)
 元素的原子核外共有
元素的原子核外共有(3)某同学推断
 元素基态原子的核外电子轨道表示式为
元素基态原子的核外电子轨道表示式为 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了 远远大于
远远大于 ,其原因是
,其原因是(4)
 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是(5)
 位于元素周期表中
位于元素周期表中 时产生蓝色沉淀该反应的离子方程式为
时产生蓝色沉淀该反应的离子方程式为
您最近一年使用:0次



