名校
解题方法
1 . X、Y、Z、W是原子序数依次增大的前20号元素,常温下只有一种元素的单质为气态。基态X原子s轨道上的电子数是p轨道上的2倍,Y的简单氢化物与其最高价含氧酸反应会产生白烟,Z与X形成的某种化合物常温下为液体,基态W原子有1个未成对电子。下列说法错误的是
| A.氢化物的沸点:Y>Z>X |
| B.电负性:Y>Z>X>W |
| C.原子半径:W>Z>X>Y |
| D.上述元素形成的某种化合物的溶液可用于检测Fe3+ |
您最近一年使用:0次
2 . 钴及其化合物具有广泛的用途,我国古代用的陶器釉料中就含有氧化钴。随着科技的不断发展,钴及其化合物成为制造合金、陶瓷颜料、催化剂、电池的重要原料之一,钴被也称为“工业味精”和“工业牙齿”,是重要的战略资源之一。回答下列问题。
(1)基态钴原子的价层电子排布式为_____ ,钴成为阳离子时首先失去_______ 轨道电子。
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子___________ (填“大”“小”或“相同”),其原因为___________ 。
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
① 中N的杂化方式为
中N的杂化方式为___________ 。
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是____________ 。
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是___________ (填序号)。
A.NH3 B.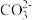 C.
C. D.H2O
D.H2O
(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为___________ ,晶体中正四面体空隙数与正八面体空隙数之比为___________ 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为___________ g·cm-3(用含a和NA的代数式表示)。
(1)基态钴原子的价层电子排布式为
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
①
 中N的杂化方式为
中N的杂化方式为②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是
A.NH3 B.
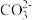 C.
C. D.H2O
D.H2O(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为
您最近一年使用:0次
名校
解题方法
3 . 2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态S原子核外有___________ 个电子自旋状态相同。基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)CH3CN中C原子的杂化类型为___________ 。
(6)等物质的量的CH3CN和CO中,π键数目之比___________ 。
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。

(1)Li、P、S三种元素中,电负性最小的是
(2)基态S原子核外有
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)CH3CN中C原子的杂化类型为
(6)等物质的量的CH3CN和CO中,π键数目之比
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
2023-04-06更新
|
739次组卷
|
4卷引用:甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题
甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题河南省郑州市2023届高三下学期第二次质量预测理科综合化学试题(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
4 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的电子排布式为[Ar]___________ ,Ti原子核外有___________ 种空间运动状态不同的电子。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由大到小的顺序为___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为___________ 。
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③乙二胺形成配合物后,H-N-H键角将变大,原因是___________ 。
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为___________ pm(列出计算式)。

(1)基态Ti原子的电子排布式为[Ar]
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③乙二胺形成配合物后,H-N-H键角将变大,原因是
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为

您最近一年使用:0次
2022-03-10更新
|
230次组卷
|
2卷引用:甘肃省张掖市民乐县第一中学2023-2024学年高三上学期第二次诊断(期中)考试化学试题



