名校
解题方法
1 . 我国科学家利用过渡金属碳化物(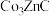 )合成了钴单质催化剂(
)合成了钴单质催化剂(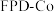 ),其晶胞转化如图所示。
),其晶胞转化如图所示。 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;
② 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
下列说法错误的是
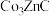 )合成了钴单质催化剂(
)合成了钴单质催化剂(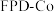 ),其晶胞转化如图所示。
),其晶胞转化如图所示。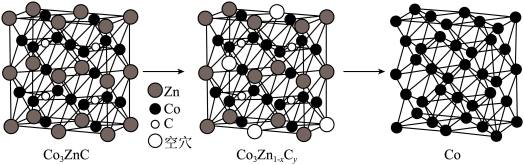
 ,底长为
,底长为 、宽为
、宽为 、高为
、高为 ;
;②
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。下列说法错误的是
A.同周期基态原子,与 原子中所含单电子数相同的原子有2种 原子中所含单电子数相同的原子有2种 |
B.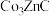 晶胞中与C原子距离最近的 晶胞中与C原子距离最近的 原子形成正八面体结构 原子形成正八面体结构 |
C. 晶胞中 晶胞中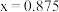 |
D.钴晶胞的密度为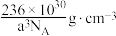 |
您最近一年使用:0次
解题方法
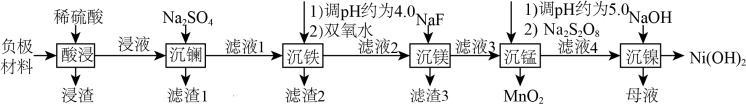
2 . 氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、MnO2、石墨粉等)进行湿法处理的流程如图所示:
②Ksp(MgF2)=6.4 ;
;
③H2SO4第一步完全电离,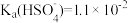 。
。
回答下列问题:
(1)Ni2+的价层电子排布式为_____________ 。
(2)能提高“酸浸”效率的措施有_____________ (任写一种)。
(3)若滤渣1的成分为 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因_________________ 。
(5)“沉镁”后滤液3中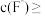
__________  (溶液中离子浓度
(溶液中离子浓度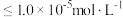 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。
(6) 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为_________________ 。
(7)“沉镍”所用试剂不宜选用氨水的原因为_________________ ,母液中可提取出的循环利用的物质为_____________ (填化学式)。
②Ksp(MgF2)=6.4
 ;
;③H2SO4第一步完全电离,
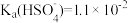 。
。回答下列问题:
(1)Ni2+的价层电子排布式为
(2)能提高“酸浸”效率的措施有
(3)若滤渣1的成分为
 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因 
| A.KSCN溶液 |
| B.K3[Fe(CN)6]溶液 |
| C.NaOH溶液 |
| D.KSCN溶液和氯水 |
(5)“沉镁”后滤液3中
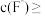
 (溶液中离子浓度
(溶液中离子浓度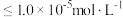 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。(6)
 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为(7)“沉镍”所用试剂不宜选用氨水的原因为
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)1 mol CO2中含有的σ键数目为_______ ,π键数目为_______ 。
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______ 。
(3)铜原子的价层电子排布图:_______ ,写出钴的简化电子排布式_______ ,基态Fe2+与Fe3+离子中未成对的电子数之比为_______ 。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______ 、_______ (填标号)。
A. B.
B. 
C.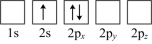 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为_______ 。
②1 mol bte分子中含σ键的数目为_______ mol。
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为_______ 。

(1)1 mol CO2中含有的σ键数目为
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是
(3)铜原子的价层电子排布图:
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为
②1 mol bte分子中含σ键的数目为
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为

您最近一年使用:0次
23-24高三上·江西·阶段练习
4 . 我国科学家用粗氢氧化高钴 制备硫酸钴晶体(
制备硫酸钴晶体(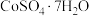 ),其工艺流程如下:
),其工艺流程如下:

已知:ⅰ.还原浸出液中的阳离子有: 、
、 、
、 和
和 等
等
ⅱ.部分物质的溶度积常数(25℃)
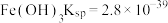
ⅲ.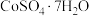 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大
(1)Co元素位于元素周期表的_______ 区,基态Co原子的核外电子排布式为_______ 。
(2)浸出 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为_______ 。
(3)写出“氧化沉铁”的离子方程式_______ ,25℃时,浊液中铁离子浓度为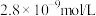 ,此时溶液
,此时溶液
_______ 。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为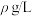 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗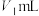 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。
计算样品中钴含量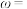
_______ (以钴的质量分数 计)。
计)。
(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高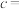
_______  (列出计算式)。
(列出计算式)。

 制备硫酸钴晶体(
制备硫酸钴晶体(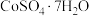 ),其工艺流程如下:
),其工艺流程如下:
已知:ⅰ.还原浸出液中的阳离子有:
 、
、 、
、 和
和 等
等ⅱ.部分物质的溶度积常数(25℃)

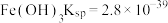
ⅲ.
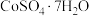 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大(1)Co元素位于元素周期表的
(2)浸出
 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为(3)写出“氧化沉铁”的离子方程式
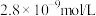 ,此时溶液
,此时溶液
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为
 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为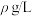 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗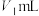 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。计算样品中钴含量
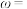
 计)。
计)。(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高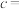
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
23-24高三上·安徽·阶段练习
名校
解题方法
5 . X、Y、Z、W是原子序数依次增大的前20号元素,常温下只有一种元素的单质为气态。基态X原子s轨道上的电子数是p轨道上的2倍,Y的简单氢化物与其最高价含氧酸反应会产生白烟,Z与X形成的某种化合物常温下为液体,基态W原子有1个未成对电子。下列说法错误的是
| A.氢化物的沸点:Y>Z>X |
| B.电负性:Y>Z>X>W |
| C.原子半径:W>Z>X>Y |
| D.上述元素形成的某种化合物的溶液可用于检测Fe3+ |
您最近一年使用:0次
名校
解题方法
6 . 次磷酸钠(NaH2PO2)是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠(NaH2PO2)广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
(1)基态Ni原子的核外电子排布式为_____ ,PH3的分子空间构型为_____ 。
(2)“碱溶”过程中,发生反应化学方程式为_____ 。
(3)“沉降池”中通入氨气的目的是_____ ,“净化”操作需要过滤、洗涤、干燥,洗涤时,选用的洗涤剂为_____ 。
(4)“滤液2”经分离提纯可以得H3PO2,写出“镀镍”过程发生的离子反应方程式_____ ,充分反应后,向“滤液2”中,加入适量 悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
_____ [已知: ,
, ]
]
(5)Ni和La的合金是目前使用广泛的储氢材料,该合金的晶胞结构如图所示。_____ 。
②已知该晶体晶胞底面边长为apm,高为cpm,设 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为_____  (用含a、c、
(用含a、c、 的代数式表示)
的代数式表示)
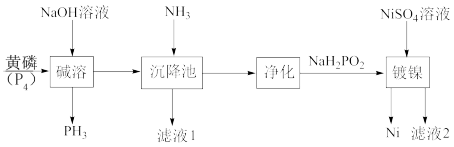
(1)基态Ni原子的核外电子排布式为
(2)“碱溶”过程中,发生反应化学方程式为
(3)“沉降池”中通入氨气的目的是
(4)“滤液2”经分离提纯可以得H3PO2,写出“镀镍”过程发生的离子反应方程式
 悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
 ,
, ]
](5)Ni和La的合金是目前使用广泛的储氢材料,该合金的晶胞结构如图所示。
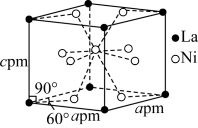
②已知该晶体晶胞底面边长为apm,高为cpm,设
 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)
的代数式表示)
您最近一年使用:0次
2023-09-15更新
|
133次组卷
|
2卷引用:甘肃省酒泉市瓜州县第一中学2023-2024学年高三上学期期末化学试题
名校
解题方法
7 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)比较NH3分子(前者)和在 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者___________ 后者。(填“>”、“<”或“=”)
(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。

(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)比较NH3分子(前者)和在
 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-09-13更新
|
261次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三10月月考化学试题
8 . 钴及其化合物具有广泛的用途,我国古代用的陶器釉料中就含有氧化钴。随着科技的不断发展,钴及其化合物成为制造合金、陶瓷颜料、催化剂、电池的重要原料之一,钴被也称为“工业味精”和“工业牙齿”,是重要的战略资源之一。回答下列问题。
(1)基态钴原子的价层电子排布式为_____ ,钴成为阳离子时首先失去_______ 轨道电子。
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子___________ (填“大”“小”或“相同”),其原因为___________ 。
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
① 中N的杂化方式为
中N的杂化方式为___________ 。
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是____________ 。
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是___________ (填序号)。
A.NH3 B. C.
C. D.H2O
D.H2O
(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为___________ ,晶体中正四面体空隙数与正八面体空隙数之比为___________ 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为___________ g·cm-3(用含a和NA的代数式表示)。
(1)基态钴原子的价层电子排布式为
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
①
 中N的杂化方式为
中N的杂化方式为②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是
A.NH3 B.
 C.
C. D.H2O
D.H2O(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为
您最近一年使用:0次
名校
解题方法
9 . 2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态S原子核外有___________ 个电子自旋状态相同。基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)CH3CN中C原子的杂化类型为___________ 。
(6)等物质的量的CH3CN和CO中,π键数目之比___________ 。
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。

(1)Li、P、S三种元素中,电负性最小的是
(2)基态S原子核外有
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)CH3CN中C原子的杂化类型为
(6)等物质的量的CH3CN和CO中,π键数目之比
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
2023-04-06更新
|
735次组卷
|
4卷引用:甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题
甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题河南省郑州市2023届高三下学期第二次质量预测理科综合化学试题(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为_____ (填字母)。
(2)NF3是一种优良的等离子蚀刻气体,在芯片制造、高能激光器领域有广泛应用,NF3是_____ (填“极性”或“非极性”)分子。
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:_____ 。
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为______ 。该储氢材料储氢时,氢分子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为_____ 。

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是_____ 。若晶胞的密度为dg•cm-3,则Cu原子与Br原子之间的最短距离为____ (列出计算式即可,NA表示阿伏加德罗常数的值)。

(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为
A.1s22s22p 2p 2p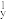 2p 2p | B.1s22s22p 2p 2p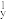 3s1 3s1 |
C.1s22s22p 2p 2p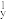 | D.1s22s22p 3s1 3s1 |
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是

您最近一年使用:0次
2022-12-16更新
|
139次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题



