名校
1 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)基态Cu2+核外电子排布式为____ 。
(2) 的空间构型为
的空间构型为_____ (用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为______ (填元素符号)。CuSO4和NaOH反应得到的氢氧化铜还能与氨水反应,写出氢氧化铜与氨水的化学反应方程式_________ 。
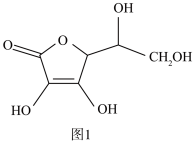
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。抗坏血酸中是否存在手性碳原子?_______ (填“是”或“否”)______ 。若晶胞的边长为a pm,则Cu2O的密度表达式为____ g·cm-3。(NA代表阿伏加德罗常数的值)
(1)基态Cu2+核外电子排布式为
(2)
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
您最近一年使用:0次
名校
2 . X、Y、Z、W为前四周期原子序数依次增大的四种元素,X、Y、Z的原子半径和最外层电子数如右图所示。W的基态原子最外层只有1个电子且内层电子全部充满。下列说法正确的是


| A.第一电离能:X<Y |
| B.X、Y的简单氢化物的稳定性:X<Y |
| C.Z元素最高正化合价为+7价 |
| D.W的基态原子的电子排布式:1s22s22p63s23p64s1 |
您最近一年使用:0次
3 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。回答下列问题:

(1)j元素基态原子的电子排布式是___________ 。
(2)元素k位于周期表中___________ 区,其基态原子有___________ 个未成对电子,有___________ 种空间运动状态不同的电子。
(3)下列正确的是___________。
(4)基态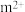 的离子结构示意图为
的离子结构示意图为___________ ,已知高温下化合物 比化合物
比化合物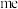 更稳定,试从
更稳定,试从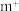 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因___________ 。
(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第___________ 周期、第___________ 族。

(1)j元素基态原子的电子排布式是
(2)元素k位于周期表中
(3)下列正确的是___________。
A.原子半径 | B.第一电离能 |
C.电负性 | D.最高价氧化物的水化物的酸性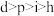 |
(4)基态
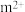 的离子结构示意图为
的离子结构示意图为 比化合物
比化合物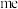 更稳定,试从
更稳定,试从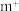 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与
 溶液反应的离子方程式
溶液反应的离子方程式(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第
您最近一年使用:0次
名校
4 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布图为 ,该同学所画的电子轨道表达式违背了
,该同学所画的电子轨道表达式违背了_________ 。
(2)A元素与C元素形成AC2化合物的电子式为________ ,A、B、C三种元素的第一电离能由大到小的顺序为__________ (用元素符号表示)。
(3)C与D形成的化合物所含的化学键类型为________ 。
(4)E基态原子中能量最高的电子,其电子云在空间有________ 个方向。
(5)F基态原子有________ 种空间运动状态不同的电子,其价层电子轨道表达式为________ 。
(6)元素铜与镍的第二电离能分别为: ,
, ,I2(Cu)> I2(Ni)。原因是
,I2(Cu)> I2(Ni)。原因是__________ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素的气态氢化物和它的最高价氧化物对应水化物能够发生化合反应 |
| C元素基态原子P轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738 kJ ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外电子排布图为
 ,该同学所画的电子轨道表达式违背了
,该同学所画的电子轨道表达式违背了(2)A元素与C元素形成AC2化合物的电子式为
(3)C与D形成的化合物所含的化学键类型为
(4)E基态原子中能量最高的电子,其电子云在空间有
(5)F基态原子有
(6)元素铜与镍的第二电离能分别为:
 ,
, ,I2(Cu)> I2(Ni)。原因是
,I2(Cu)> I2(Ni)。原因是
您最近一年使用:0次
名校
5 . 2022年9月,著名期刊Applied Catalysis。 B, Environmental。报道了一种目前催化性能最好的光催化剂TiO2‖(Cu2O)x。回答下列问题:
(1)基态钛原子的电子排布式为___________ ,核外电子占据的轨道数为___________ 。
(2)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如图所示。

①配合物中Ti的化合价为___________ 。
②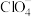 的空间结构为
的空间结构为___________ 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身被还原成氧化亚铜,乙醛中C原子的杂化轨道类型为___________ ;1 mol乙醛分子中含有的π键的数目为___________ ,乙酸的沸点明显高于乙醛,其主要原因是___________ 。
(4)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,解释高温下Cu2O比CuO更稳定的原因:_________ 。
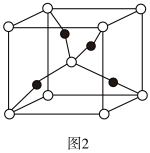
(5)Cu2O的晶胞结构如图所示,该结构中O原子的配位数是___________ ;晶胞结构为正方体,边长为a pm,则晶体的密度为___________ g·cm-3(用含NA、a的代数式表示)。

(1)基态钛原子的电子排布式为
(2)Ti可形成配合物[Ti(urea)6](ClO4)3,urea表示尿素,其结构如图所示。

①配合物中Ti的化合价为
②
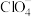 的空间结构为
的空间结构为(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身被还原成氧化亚铜,乙醛中C原子的杂化轨道类型为
(4)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,解释高温下Cu2O比CuO更稳定的原因:
(5)Cu2O的晶胞结构如图所示,该结构中O原子的配位数是

您最近一年使用:0次
名校
解题方法
6 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 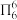 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
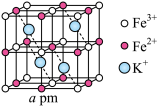
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 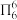 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
名校
解题方法
7 . H、N、O、S、Zn、Cu是日常生活中常见的元素。
(1)基态S原子的核外电子排布式为_____ ,其中两种自旋状态的电子数之比为_____ 。
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是_____ (填名称);第一电离能最大的元素是_____ (填名称)。1mol[Cu(NH3)4]2+中含有σ键的数目为_____ 。
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是_____ 。键角∠B-O-H不同于键角∠O-B-O的原因是_____ 。

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是__________ 。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1, ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是_____ 。
②设阿伏加德罗常数的值为NA,则GaN晶体的密度为_____ g·cm-3。
(1)基态S原子的核外电子排布式为
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1,
 ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是②设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
解题方法
8 . N、P、 均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
(1)基态P核外电子空间运动状态有__________ 种。
(2)下列状态的N原子或离子,未成对电子最多的是__________ (填序号)。
a. b.
b. c.
c.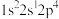 d.
d.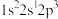
(3) 、P与S是同周期中相邻的元素,第一电离能由大到小的顺序是
、P与S是同周期中相邻的元素,第一电离能由大到小的顺序是__________ 。
(4) 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 的空间构型为
的空间构型为__________ 。
(5)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与 (即
(即 )反应生成有机化合物B,B具有优异的催化性能。
)反应生成有机化合物B,B具有优异的催化性能。

①有机物B中组成元素的电负性由小到大的顺序是__________ 。
②含 有机物B的分子结构中含
有机物B的分子结构中含__________ (填序号)。
A.离子键 B.配位键 C.大 键 D.
键 D. 键 E.氢键
键 E.氢键
(6)N与金属可形成氮化物,如 的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。
的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。
① 晶胞中,含有的Al、N原子个数均是
晶胞中,含有的Al、N原子个数均是__________ 。

②若设该氮化铁的化学式为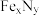 ,
, 可替代晶胞中不同位置的
可替代晶胞中不同位置的 ,形成
,形成 替代型的化学式是
替代型的化学式是 ,而
,而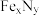 转化为两种
转化为两种 替代型产物的能量变化如图丙所示,
替代型产物的能量变化如图丙所示, 替代晶胞中的
替代晶胞中的 形成化学式为
形成化学式为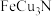 的氮化物不稳定,则a位置表示晶胞中的
的氮化物不稳定,则a位置表示晶胞中的__________ 。
③通常认为 是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据
是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据__________ (填“能”或“不能”)计算出 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为__________  。
。

 均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:(1)基态P核外电子空间运动状态有
(2)下列状态的N原子或离子,未成对电子最多的是
a.
 b.
b. c.
c.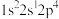 d.
d.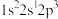
(3)
 、P与S是同周期中相邻的元素,第一电离能由大到小的顺序是
、P与S是同周期中相邻的元素,第一电离能由大到小的顺序是(4)
 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 的空间构型为
的空间构型为(5)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与
 (即
(即 )反应生成有机化合物B,B具有优异的催化性能。
)反应生成有机化合物B,B具有优异的催化性能。
①有机物B中组成元素的电负性由小到大的顺序是
②含
 有机物B的分子结构中含
有机物B的分子结构中含A.离子键 B.配位键 C.大
 键 D.
键 D. 键 E.氢键
键 E.氢键(6)N与金属可形成氮化物,如
 的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。
的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。①
 晶胞中,含有的Al、N原子个数均是
晶胞中,含有的Al、N原子个数均是
②若设该氮化铁的化学式为
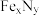 ,
, 可替代晶胞中不同位置的
可替代晶胞中不同位置的 ,形成
,形成 替代型的化学式是
替代型的化学式是 ,而
,而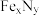 转化为两种
转化为两种 替代型产物的能量变化如图丙所示,
替代型产物的能量变化如图丙所示, 替代晶胞中的
替代晶胞中的 形成化学式为
形成化学式为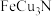 的氮化物不稳定,则a位置表示晶胞中的
的氮化物不稳定,则a位置表示晶胞中的③通常认为
 是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据
是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为 。
。
您最近一年使用:0次
9 . 物质结构理论是材料科学、医学科学和生命科学的重要基础。请回答:
(1)Ni常常作为有机反应的催化剂,在元素周期表的位置为_______ ,基态原子镍原子占据最高能级的电子云轮廓图为_______ 。
(2)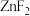 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是_______ ;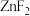 不溶于有机溶剂而
不溶于有机溶剂而 、
、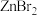 、
、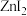 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是_______ 。
(3)下列说法正确的是_______。

(4)锌黄锡矿外观漂亮,晶胞结构如图所示,请写出锌黄锡矿的化学式_______ ;并在晶胞中找出平移能完全重合的两个
_______ 。(请选择合适的编号填写一种组合)

(1)Ni常常作为有机反应的催化剂,在元素周期表的位置为
(2)
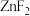 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是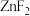 不溶于有机溶剂而
不溶于有机溶剂而 、
、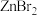 、
、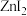 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是(3)下列说法正确的是_______。

| A.现代化学,常利用原子光谱上特征谱线鉴定元素 |
| B.电负性大于1.8一定是非金属 |
| C.配合物的稳定性不仅与配体有关,还与中心原子的所带电荷等因素有关 |
D. 晶体的密度为 晶体的密度为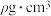 ,图示晶胞 ,图示晶胞 与 与 的距离 的距离 |


您最近一年使用:0次
解题方法
10 . VA族氮、磷、砷(As)、锑(Sb)元素及其化合物应用广泛。 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄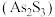 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄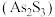 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是A. 是由极性键形成的非极性分子 是由极性键形成的非极性分子 |
B.P4是正四面体形分子,其中P-P-P夹角为 |
| C.VA族元素单质的晶体类型相同 |
D.基态砷原子(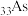 )核外电子排布式为 )核外电子排布式为 |
您最近一年使用:0次



