名校
解题方法
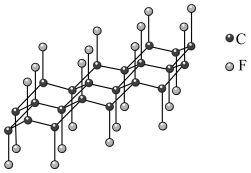
1 . 秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料,直到近年来人们才研究出来其成分为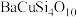 ,
,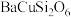 。试回答下列问题:
。试回答下列问题:
(1)“中国蓝”、“中国紫”中均具有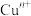 离子,
离子,
______ ,基态时该阳离子的价电子排布式为______ ,“中国蓝”的发色中心是以 为中心的配位化合物,形成该配位键,
为中心的配位化合物,形成该配位键, 提供
提供______ 。
(2)合成“中国蓝”、“中国紫”的原料有 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是
)。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是______ 。
(3)在5500年前,古代埃及人就已经知道如何合成蓝色颜料——“埃及蓝”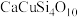 ,其合成原料中用
,其合成原料中用 代替了
代替了 ,其他和“中国蓝”一致。
,其他和“中国蓝”一致。 中键角为
中键角为______ 。从原料分解的角度判断,“埃及蓝”的合成温度比“中国蓝”更低,这是因为 比
比 更易形成。根据所学,试解释:
更易形成。根据所学,试解释:______ 。
(4) 和
和 同主族,但
同主族,但 与
与 的熔沸点差异很大,这是因为
的熔沸点差异很大,这是因为______ 。
(5)现代工业利用铜氨溶液溶解纤维制造人造丝。金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色铜氨溶液,写出离子方程式:______ 。
(6)氯化亚铜的晶胞结构如图所示。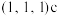 点坐标为
点坐标为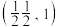 ,则b点的坐标为
,则b点的坐标为______ 。
②设 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为 ,则该晶体的密度
,则该晶体的密度
______  (列出计算式即可)。
(列出计算式即可)。
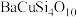 ,
,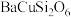 。试回答下列问题:
。试回答下列问题:(1)“中国蓝”、“中国紫”中均具有
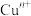 离子,
离子,
 为中心的配位化合物,形成该配位键,
为中心的配位化合物,形成该配位键, 提供
提供(2)合成“中国蓝”、“中国紫”的原料有
 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是
)。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是(3)在5500年前,古代埃及人就已经知道如何合成蓝色颜料——“埃及蓝”
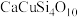 ,其合成原料中用
,其合成原料中用 代替了
代替了 ,其他和“中国蓝”一致。
,其他和“中国蓝”一致。 中键角为
中键角为 比
比 更易形成。根据所学,试解释:
更易形成。根据所学,试解释:(4)
 和
和 同主族,但
同主族,但 与
与 的熔沸点差异很大,这是因为
的熔沸点差异很大,这是因为(5)现代工业利用铜氨溶液溶解纤维制造人造丝。金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色铜氨溶液,写出离子方程式:
(6)氯化亚铜的晶胞结构如图所示。
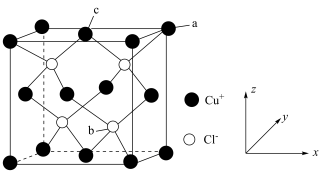
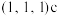 点坐标为
点坐标为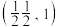 ,则b点的坐标为
,则b点的坐标为②设
 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为 ,则该晶体的密度
,则该晶体的密度
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
2 . 氟化物在生产、生活和科研中应用广泛。请回答下列问题:
(1)基态氟原子核外电子的空间运动状态有________ 种,核外电子的最高能级的原子轨道相互________ 。
(2)夜明珠的主要成分是 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为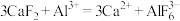 ,下列对
,下列对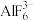 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。
(3) 与一定量的水形成
与一定量的水形成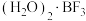 ,一定条件下
,一定条件下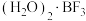 可发生如下转化:
可发生如下转化:________ (填“无”或“有”)离子键形成。 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。 的导电性
的导电性________ (填“增强”或“减弱”)。
②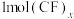 中含有
中含有________ molσ键(用含x的代数式表示)。
(5) 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是________ 球(填“黑”或“白”)。已知晶胞中A、B原子间距离为xpm,则B、C间距离为________ pm(用含a、c、x的代数式表示)。
(1)基态氟原子核外电子的空间运动状态有
(2)夜明珠的主要成分是
 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为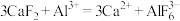 ,下列对
,下列对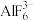 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。A. | B. | C. | D. |
(3)
 与一定量的水形成
与一定量的水形成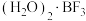 ,一定条件下
,一定条件下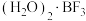 可发生如下转化:
可发生如下转化: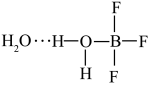

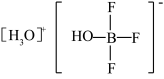
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如 分子中存在“离域π键”,可表示成
分子中存在“离域π键”,可表示成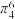 。实验测得
。实验测得 中硼氟键的键长比
中硼氟键的键长比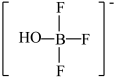 中B-F键的键长小,原因是
中B-F键的键长小,原因是
 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。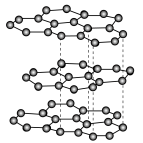
 的导电性
的导电性②
 中含有
中含有(5)
 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是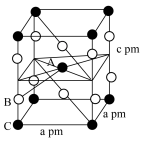
您最近一年使用:0次
3 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
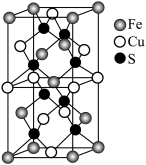
(1)基态铁原子的核外电子排布式为_______ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为_______ 。
②异硫氰酸的沸点比硫氰酸高的原因是_______ 。
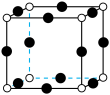
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为_______ 。AlF3结构属立方晶系,其晶胞如图1所示,F的配位数为_______ 。_______ cm(用含有ρ、NA的代数式表示)。_______ ;若晶胞的底面边长为apm,高为bpm,阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3(用含有a、b、NA的代数式表示)。
(1)基态铁原子的核外电子排布式为
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为
②异硫氰酸的沸点比硫氰酸高的原因是
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为
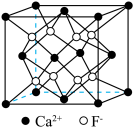
您最近一年使用:0次
4 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
名校
解题方法
5 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为_______ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“_______ 理论”解释。
(2)已知金属锰有多种晶型,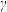 型锰的面心立方晶胞沿轴的投影图,符合下列
型锰的面心立方晶胞沿轴的投影图,符合下列_______ (填序号),每个Mn原子周围紧邻的Mn原子数为_______ 个。 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为_______ , 的空间构型是
的空间构型是_______ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(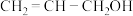 ),其相对分子质量等于丙醛(
),其相对分子质量等于丙醛(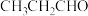 ),但两者沸点相差较大,原因是
),但两者沸点相差较大,原因是_______ 。
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为_______ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为_______ g(用含a、 的代数式表示)。
的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,
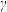 型锰的面心立方晶胞沿轴的投影图,符合下列
型锰的面心立方晶胞沿轴的投影图,符合下列A.  B.
B.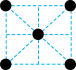 C.
C. 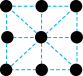 D.
D.
 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(
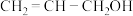 ),其相对分子质量等于丙醛(
),其相对分子质量等于丙醛(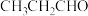 ),但两者沸点相差较大,原因是
),但两者沸点相差较大,原因是(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为
 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为 的代数式表示)。
的代数式表示)。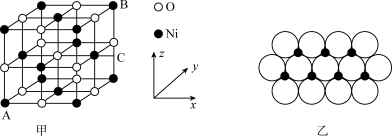
您最近一年使用:0次
解题方法
6 . 锂、铁和硒(Se)在电池、医药、催化、材料等领域有广泛应用。回答下列问题:
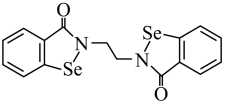
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构简式如下:_______ 。
②该新药分子中有_______ 种不同化学环境的C原子。
③ 离子的空间构型为
离子的空间构型为_______ 。
(2)富马酸亚铁(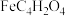 )是一种补铁剂。富马酸分子的结构模型如图所示:
)是一种补铁剂。富马酸分子的结构模型如图所示:_______ 。
②富马酸亚铁中非金属元素的电负性由大到小的顺序为_______ 。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:_______ 。
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)Li、Fe、Se可形成新型超导材料,晶胞如图(Fe原子均位于面上)。晶胞各棱边之间的夹角均为 ,X的分数坐标为
,X的分数坐标为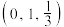 ,Y的分数坐标为
,Y的分数坐标为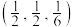 。设
。设 为阿伏加德罗常数的值,Se原子X与Se原子Y之间的距离为
为阿伏加德罗常数的值,Se原子X与Se原子Y之间的距离为_______ nm(用含a、b的式子表示)。(已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标)
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构简式如下:
②该新药分子中有
③
 离子的空间构型为
离子的空间构型为(2)富马酸亚铁(
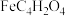 )是一种补铁剂。富马酸分子的结构模型如图所示:
)是一种补铁剂。富马酸分子的结构模型如图所示: 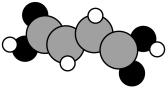
②富马酸亚铁中非金属元素的电负性由大到小的顺序为
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示: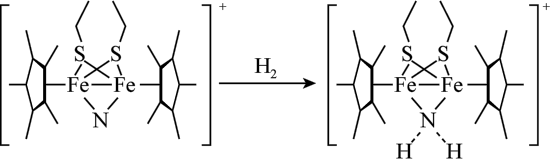
②与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)Li、Fe、Se可形成新型超导材料,晶胞如图(Fe原子均位于面上)。晶胞各棱边之间的夹角均为
 ,X的分数坐标为
,X的分数坐标为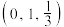 ,Y的分数坐标为
,Y的分数坐标为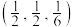 。设
。设 为阿伏加德罗常数的值,Se原子X与Se原子Y之间的距离为
为阿伏加德罗常数的值,Se原子X与Se原子Y之间的距离为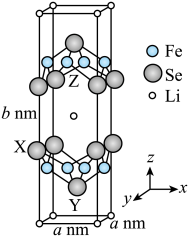
您最近一年使用:0次
解题方法
7 . 磷、硼及其化合物用途非常广泛。回答下列问题:
(1)镍的一种配合物为 ,Ph表示苯基。
,Ph表示苯基。
①基态Ni原子价电子排布式为___________ ;镍在周期表中位于第___________ 周期第___________ 族。
②配体为___________ ; 分子中含σ键数为
分子中含σ键数为___________ 个。
(2) 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应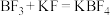 制备。
制备。
① 中阴离子空间构型为
中阴离子空间构型为___________ ,该物质中含有的化学键类型有___________ (填字母)
A.离子键 B.共价键 C.配位键 D.氢键
② 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是___________ 。
(3)磷化硼是一种半导体材料,密度为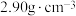 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于___________ 晶体;其晶胞参数a=___________ nm(列出计算式)。

(1)镍的一种配合物为
 ,Ph表示苯基。
,Ph表示苯基。①基态Ni原子价电子排布式为
②配体为
 分子中含σ键数为
分子中含σ键数为(2)
 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应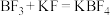 制备。
制备。①
 中阴离子空间构型为
中阴离子空间构型为A.离子键 B.共价键 C.配位键 D.氢键
②
 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是(3)磷化硼是一种半导体材料,密度为
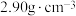 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
您最近一年使用:0次
名校
解题方法
8 . 美国某大学一课题组在金属有机框架(MOF)中成功构筑了含有双核镍氢中心 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: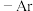 ,
, 为芳烃基,
为芳烃基, ,
,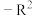 为烃基。
为烃基。
(1)基态镍原子的价层电子排布式为___________ 。
(2)甲、乙、丙、丁四种物质中,碳原子共有___________ 种杂化类型,这四种物质都含有的化学键类型为___________ (填标号)。
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供___________ (填“空轨道”或“孤电子对”,下同),氮原子提供___________ 形成配位键。
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为___________ (填元素符号,下同),电负性由小到大的顺序为___________ 。
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为___________ pm。该晶体密度为___________  。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: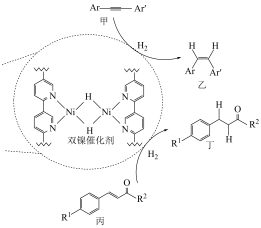
 ,
, 为芳烃基,
为芳烃基, ,
, 为烃基。
为烃基。(1)基态镍原子的价层电子排布式为
(2)甲、乙、丙、丁四种物质中,碳原子共有
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为
 。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
您最近一年使用:0次
2024-02-25更新
|
358次组卷
|
5卷引用:2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学
名校
9 . Ⅰ.镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_____ 。
(2)一种含镓的药物合成方法如图所示:____ ,
_____ 。
Ⅱ.硒是人体需要的重要微量元素之一,参与体内多种代谢。
(3)①在同一周期中比Se元素的第一电离能大的元素有____ 种。
②Se的某种同素异形体 为环状结构,是
为环状结构,是 的等电子体,
的等电子体,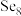 环中Se原子的杂化方式为
环中Se原子的杂化方式为_____ 。Se−Se−Se平均键角最接近:____ (填选项序号)。
a. b.
b. c.
c.
(4)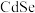 的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为
的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为 ,则C的原子坐标参数分别为
,则C的原子坐标参数分别为_____ ,已知Cd和Se的原子半径分别为b nm和c nm,则该晶胞中原子的体积占晶胞体积的百分率为_____ (列出计算式)。
(1)基态Ga原子的价层电子排布式为
(2)一种含镓的药物合成方法如图所示:
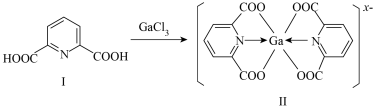

Ⅱ.硒是人体需要的重要微量元素之一,参与体内多种代谢。
(3)①在同一周期中比Se元素的第一电离能大的元素有
②Se的某种同素异形体
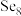 为环状结构,是
为环状结构,是 的等电子体,
的等电子体,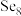 环中Se原子的杂化方式为
环中Se原子的杂化方式为a.
 b.
b. c.
c.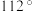
(4)
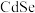 的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为
的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为 ,则C的原子坐标参数分别为
,则C的原子坐标参数分别为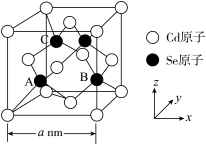
您最近一年使用:0次
2024-02-17更新
|
676次组卷
|
4卷引用:2024届陕西省西安市西北工业大学附属中学高三上学期第二次模拟考试理科综合试题-高中化学
名校
解题方法
10 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)属于氟原子激发态的电子排布式有_______ (填字母)。
a. b.
b. c.
c. d.
d.
(2)第三周期部分主族元素的氟化物的熔点(见表):
 比
比 熔点低的原因是
熔点低的原因是_______ 。
(3) 中心原子为
中心原子为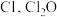 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大π键
中存在大π键 。
。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为_______ ;比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_______ 。
(4) 与其他卤素单质反应可以形成卤素互化物,例如
与其他卤素单质反应可以形成卤素互化物,例如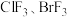 等。已知
等。已知 的键能为
的键能为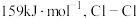 的键能为
的键能为 的键能为
的键能为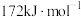 ,写出
,写出 和
和 生成
生成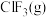 的热化学方程式
的热化学方程式_______ 。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图。
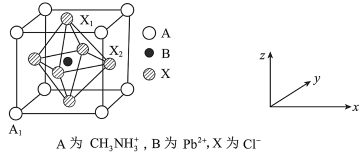
①原子坐标参数 为
为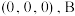 为
为 ,则
,则 为
为_______ 。
②在该晶胞的另一种表达方式中,若图中 处于顶点位置,则
处于顶点位置,则 处于
处于_______ 位置。
(6)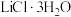 属于正交晶系(长方体形),晶胞参数为
属于正交晶系(长方体形),晶胞参数为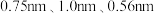 。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
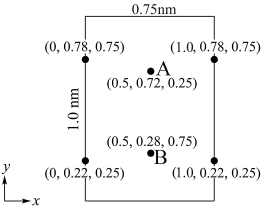
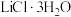 的摩尔质量为
的摩尔质量为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为_______  (列出计算式)。
(列出计算式)。
(1)属于氟原子激发态的电子排布式有
a.
 b.
b. c.
c. d.
d.
(2)第三周期部分主族元素的氟化物的熔点(见表):
| 化合物 |  |  |  |  |
| 熔点/℃ | 993 | 1040 | 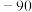 | 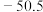 |
 比
比 熔点低的原因是
熔点低的原因是(3)
 中心原子为
中心原子为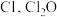 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大π键
中存在大π键 。
。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)
 与其他卤素单质反应可以形成卤素互化物,例如
与其他卤素单质反应可以形成卤素互化物,例如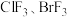 等。已知
等。已知 的键能为
的键能为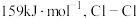 的键能为
的键能为 的键能为
的键能为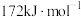 ,写出
,写出 和
和 生成
生成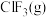 的热化学方程式
的热化学方程式(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图。

①原子坐标参数
 为
为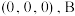 为
为 ,则
,则 为
为②在该晶胞的另一种表达方式中,若图中
 处于顶点位置,则
处于顶点位置,则 处于
处于(6)
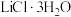 属于正交晶系(长方体形),晶胞参数为
属于正交晶系(长方体形),晶胞参数为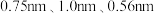 。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
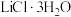 的摩尔质量为
的摩尔质量为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



