氟化物在生产、生活和科研中应用广泛。请回答下列问题:
(1)基态氟原子核外电子的空间运动状态有________ 种,核外电子的最高能级的原子轨道相互________ 。
(2)夜明珠的主要成分是 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为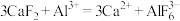 ,下列对
,下列对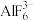 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。
(3) 与一定量的水形成
与一定量的水形成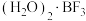 ,一定条件下
,一定条件下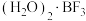 可发生如下转化:
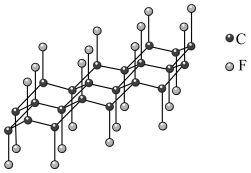
可发生如下转化:________ (填“无”或“有”)离子键形成。 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。 的导电性
的导电性________ (填“增强”或“减弱”)。
②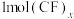 中含有
中含有________ molσ键(用含x的代数式表示)。
(5) 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是________ 球(填“黑”或“白”)。已知晶胞中A、B原子间距离为xpm,则B、C间距离为________ pm(用含a、c、x的代数式表示)。
(1)基态氟原子核外电子的空间运动状态有
(2)夜明珠的主要成分是
 。
。 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,其反应为
的溶液中,其反应为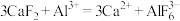 ,下列对
,下列对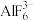 中心原子杂化方式推断合理的是________(填字母)。
中心原子杂化方式推断合理的是________(填字母)。A. | B. | C. | D. |
(3)
 与一定量的水形成
与一定量的水形成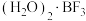 ,一定条件下
,一定条件下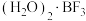 可发生如下转化:
可发生如下转化: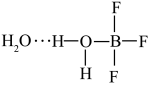

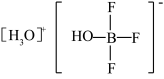
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如 分子中存在“离域π键”,可表示成
分子中存在“离域π键”,可表示成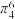 。实验测得
。实验测得 中硼氟键的键长比
中硼氟键的键长比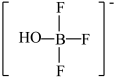 中B-F键的键长小,原因是
中B-F键的键长小,原因是
 (该物质仍具有润滑性),其单层局部结构如图所示。
(该物质仍具有润滑性),其单层局部结构如图所示。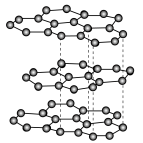
 的导电性
的导电性②
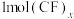 中含有
中含有(5)
 晶体属四方晶系(晶胞参数
晶体属四方晶系(晶胞参数 ),晶胞中代表Xe的是
),晶胞中代表Xe的是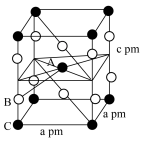
更新时间:2024-05-29 20:55:10
|
相似题推荐
【推荐1】植物生长需要多种矿质元素,其中必须元素就多达14种,需要量比较大的有镁、硫、铁等元素。回答下列问题。
(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为_______ 。
(2)第3周期中,第一电离能大于S的元素有_______ (填元素符号)。
(3)经研究表明Fe3+可以形成配离子[FeCl2(H2O)4]+,与游离的H2O分子相比,其H—O—H键角_______ (填“较大”,“较小”或“相同”),原因是_______ 。
(4)Mg与H2在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90℃,储氢物质X的化学式为_______ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如C点原子的分数坐标为(1,0,0)。已知Mg—H键的键长为r pm,A点位于面对角线上,其原子分数坐标为_______ ,晶胞中A、B两个H之间的核间距d=_______ pm(用代数式表示)。

(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为
(2)第3周期中,第一电离能大于S的元素有
(3)经研究表明Fe3+可以形成配离子[FeCl2(H2O)4]+,与游离的H2O分子相比,其H—O—H键角
(4)Mg与H2在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90℃,储氢物质X的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】在月球玄武岩中发现了钛铁矿(主要成分的化学式含Ti、Fe、O三种元素),钛铁矿广泛应用于各个领域,包括冶金、化工、建筑、航空航天、电子等。请回答下列有关问题:
(1)铁在周期表中的位置是___________ 。
(2)基态钛原子的价层电子排布式为___________ ,其最外层电子的电子云轮廓图为___________ 。
(3)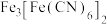 中的配体为
中的配体为___________ ;其中 C原子的杂化类型为___________ ,1 mol 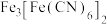 含有的σ键数目为
含有的σ键数目为___________ 。
(4)Ti的四卤化物的熔点如表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,其原因是___________ 。
(5)钛铁矿主要成分的晶胞为立方体,其结构如图所示,钛铁矿主要成分的化学式为___________ ;已知该晶胞参数为a pm,NA为阿伏加德罗常数值,则该晶胞的密度为___________ g/cm3(用含a、NA的代数式表示)。
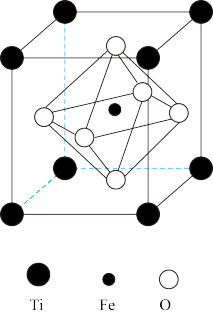
(1)铁在周期表中的位置是
(2)基态钛原子的价层电子排布式为
(3)
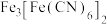 中的配体为
中的配体为 含有的σ键数目为
含有的σ键数目为(4)Ti的四卤化物的熔点如表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,其原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】根据所学物质结构与性质的知识回答下列问题。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
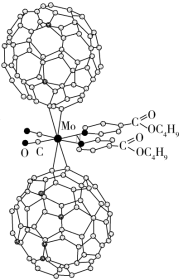
①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是___________ ,该超分子中存在的化学键类型有___________ (填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过___________ 方法区分晶体、准晶体和非晶体。
②AsF3、IF 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是___________ (填化学式,下同),其立体构型为___________ 。
③室温氟穿梭电池的电解质为氟氢离子液体,含HF 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式___________ 。
④基于CaF2设计的Born-Haber循环如图所示。
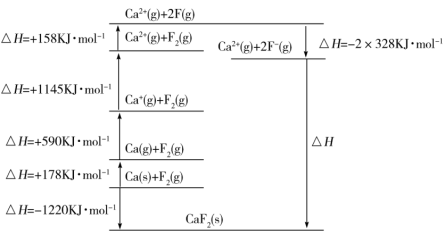
钙的第一电离能为___________ kJ·mol-1;F-F键的键能为___________ kJ·mol-1。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过
②AsF3、IF
 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是③室温氟穿梭电池的电解质为氟氢离子液体,含HF
 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】锗在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。回答下列问题:
(1)基态锗原子最外层电子排布图为_______ ,Ge原子的电子发生跃迁时会吸收或放出不同的光,可用_______  填仪器名称
填仪器名称 摄取其原子光谱,从而鉴定Ge元素的存在。
摄取其原子光谱,从而鉴定Ge元素的存在。
(2)锗元素能形成无机化合物 如锗酸钠:
如锗酸钠: ;二锗酸钠:
;二锗酸钠: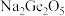 ;四锗酸钠:
;四锗酸钠: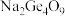 等
等 ,也能形成类似于烷烃的锗烷
,也能形成类似于烷烃的锗烷 。
。
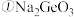 中锗原子的杂化方式为
中锗原子的杂化方式为______________ 。
 锗与碳同族,性质及结构有一定的相似性,据此推测
锗与碳同族,性质及结构有一定的相似性,据此推测 二锗酸钠
二锗酸钠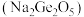 中含有的
中含有的 键的数目为
键的数目为_________ 。
 至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:
至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________ 。
(3)有机多元膦酸锗配合物是由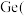 Ⅳ
Ⅳ 与
与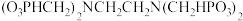 形成的,其结构如下:
形成的,其结构如下:
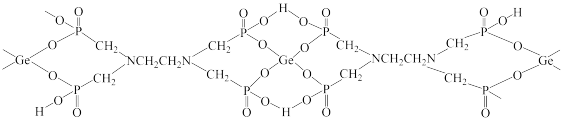
 该配合物中,下列作用力不存在的有
该配合物中,下列作用力不存在的有_________
A.极性键 非极性键
非极性键 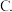 金属键
金属键  配位键
配位键 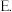 氢键
氢键 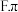 键
键
 该配合物中
该配合物中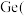 Ⅳ
Ⅳ 的配位数是
的配位数是_______ ;配位原子是_______  填元素符号
填元素符号 。
。
 试解释磷酸
试解释磷酸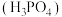 酸性为什么与亚硝酸相近?
酸性为什么与亚硝酸相近?______________ 。
(4)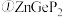 常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数
常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数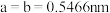 ,
,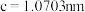 ,该晶体的密度为
,该晶体的密度为_______ 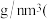 列出算式即可,阿伏加德罗常数用
列出算式即可,阿伏加德罗常数用 表示
表示 。
。
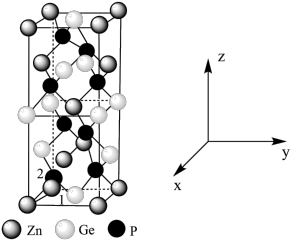
 原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则
原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则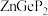 晶胞图中标号为“2”的P原子的分数坐标为
晶胞图中标号为“2”的P原子的分数坐标为_______ 。
(1)基态锗原子最外层电子排布图为
 填仪器名称
填仪器名称 摄取其原子光谱,从而鉴定Ge元素的存在。
摄取其原子光谱,从而鉴定Ge元素的存在。(2)锗元素能形成无机化合物
 如锗酸钠:
如锗酸钠: ;二锗酸钠:
;二锗酸钠: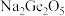 ;四锗酸钠:
;四锗酸钠: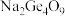 等
等 ,也能形成类似于烷烃的锗烷
,也能形成类似于烷烃的锗烷 。
。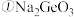 中锗原子的杂化方式为
中锗原子的杂化方式为 锗与碳同族,性质及结构有一定的相似性,据此推测
锗与碳同族,性质及结构有一定的相似性,据此推测 二锗酸钠
二锗酸钠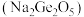 中含有的
中含有的 键的数目为
键的数目为 至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:
至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:| 化学键 |  |  |  |  |
键能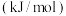 | 346 | 411 | 188 | 288 |
(3)有机多元膦酸锗配合物是由
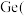 Ⅳ
Ⅳ 与
与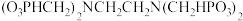 形成的,其结构如下:
形成的,其结构如下:
 该配合物中,下列作用力不存在的有
该配合物中,下列作用力不存在的有A.极性键
 非极性键
非极性键  金属键
金属键  配位键
配位键  氢键
氢键 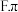 键
键 该配合物中
该配合物中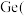 Ⅳ
Ⅳ 的配位数是
的配位数是 填元素符号
填元素符号 。
。 试解释磷酸
试解释磷酸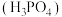 酸性为什么与亚硝酸相近?
酸性为什么与亚硝酸相近?(4)
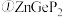 常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数
常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数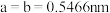 ,
,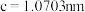 ,该晶体的密度为
,该晶体的密度为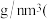 列出算式即可,阿伏加德罗常数用
列出算式即可,阿伏加德罗常数用 表示
表示 。
。
 原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则
原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则 晶胞图中标号为“2”的P原子的分数坐标为
晶胞图中标号为“2”的P原子的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铜、锌及其化合物在生产生活中有广泛应用。回答下列问题:
(1) 的价层电子排布式为
的价层电子排布式为_______ 。
(2)某锌铁氧体[化学式为ZnxFe(Ⅲ)yOZ制成的磁芯被广泛用于电子行业。
①组成微粒的原子(或离子)中存在未成对电子,该微粒具有顺磁性。指出锌铁氧体晶体中具有顺磁性的离子,并说明理由_______ 。
②锌铁氧体晶胞结构如下图所示,该晶胞由4个A型和4个B型小立方体构成。锌铁氧体的化学式为_______ 。
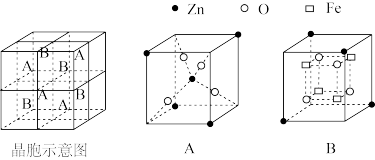
(3)铜离子在水溶液中的结构如图所示。硫酸铜稀溶液中不存在的作用力有_______ (填标号),其中硫酸根的空间构型为_______ 。
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力

(4) (式量为
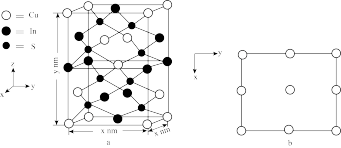
(式量为 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为_______  (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置_______ (用“●”表示S原子)。
(1)
 的价层电子排布式为
的价层电子排布式为(2)某锌铁氧体[化学式为ZnxFe(Ⅲ)yOZ制成的磁芯被广泛用于电子行业。
①组成微粒的原子(或离子)中存在未成对电子,该微粒具有顺磁性。指出锌铁氧体晶体中具有顺磁性的离子,并说明理由
②锌铁氧体晶胞结构如下图所示,该晶胞由4个A型和4个B型小立方体构成。锌铁氧体的化学式为

(3)铜离子在水溶液中的结构如图所示。硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力

(4)
 (式量为
(式量为 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
您最近一年使用:0次
【推荐3】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
I.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中存在的化学键有_______ 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
II.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子9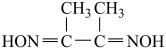 )中N原子轨道杂类型为
)中N原子轨道杂类型为_______ ,1mol丁二酮肟分子所含σ键的数目为_______ 。丁二酮肟分子在与Ni2+形成配离子时,配位原子最有可能是_____ 。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
①[Ni(CO)4]固态时属于_______ 晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为____ (用“→”表示出配位键) 。
III.填空。
(4)NaCNO是离子化合物,各原子均满足8电子稳定结构,NaCNO的电子式是_______ 。
(5)相同温度下,冰的密度比水小的主要原因是_______ 。
I.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)在[Ni(NH3)6]2+中存在的化学键有
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
II.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子9
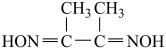 )中N原子轨道杂类型为
)中N原子轨道杂类型为(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
①[Ni(CO)4]固态时属于
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为
III.填空。
(4)NaCNO是离子化合物,各原子均满足8电子稳定结构,NaCNO的电子式是
(5)相同温度下,冰的密度比水小的主要原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
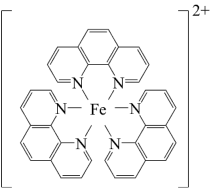
【推荐1】碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲(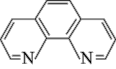 )与
)与 形成的红色配合物(如图)测定铁的含量。
形成的红色配合物(如图)测定铁的含量。
回答下列问题:
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有_______ 种。
(2)红色配合物中H、C、N、 四种元素的电负性从大到小的顺序为
四种元素的电负性从大到小的顺序为_______ 。
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为_______ 、_______ 。
(4)红色配离子的中心原子的配位数为_______ 。
(5)红色配离子中不存在的作用力有_______ (填字母)。
A. 键 B.
键 B. 键 C.离子键 D.氢键 E.配位键
键 C.离子键 D.氢键 E.配位键
(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。
(7)三甲胺[ ]和乙二胺(
]和乙二胺( )均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是_______ 。
(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3), 的空间结构为
的空间结构为_______ 。
 )与
)与 形成的红色配合物(如图)测定铁的含量。
形成的红色配合物(如图)测定铁的含量。
回答下列问题:
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)红色配合物中H、C、N、
 四种元素的电负性从大到小的顺序为
四种元素的电负性从大到小的顺序为(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为
(4)红色配离子的中心原子的配位数为
(5)红色配离子中不存在的作用力有
A.
 键 B.
键 B. 键 C.离子键 D.氢键 E.配位键
键 C.离子键 D.氢键 E.配位键(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(7)三甲胺[
 ]和乙二胺(
]和乙二胺( )均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3),
 的空间结构为
的空间结构为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是___________ 形。
(2)某有机物的结构简式为 该有机物分子是
该有机物分子是___________ (填“极性”或“非极性”)分子
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因___________ ;
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是
(2)某有机物的结构简式为
 该有机物分子是
该有机物分子是(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N
 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。| A.HN3中含有5个σ键 |
| B.HN3中的三个氮原子均采用sp2杂化 |
| C.HN3、HNO2、H2O、N2H4都是极性分子 |
| D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Ti原子s轨道上总共有_______ 个电子,其价电子轨道表达式为____________ 。
(2)在基态N原子中,核外存在______ 对自旋相反的电子,核外电子占据的最高能层符号为______ ,占据该能层电子的电子云轮廓图形状为__________________ 。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法正确的是_____ 。
A. (N5)6(H3O)3(NH4)4Cl 中含四种离子 B. N5+N5-属于化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(4)BF3分子空间结构为___________ ;在NH3中N原子的杂化方式为_______ 。
(5)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是_______ ,配体是_________ 。
(6)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
请解释碱土金属元素碳酸盐热分解温度的变化规律:_______________________ 。
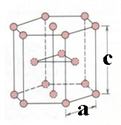
(7)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为_____ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。
(1)基态Ti原子s轨道上总共有
(2)在基态N原子中,核外存在
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法正确的是
A. (N5)6(H3O)3(NH4)4Cl 中含四种离子 B. N5+N5-属于化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(4)BF3分子空间结构为
(5)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是
(6)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:
(7)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】2021年全世界前沿新材料领域取得新的进展。推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:
(1)钛的核外电子排布式是____ ;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____ 种。
(2)钛元素的检验方法如图:

TiO2+可与H2O2形成配离子[TiO(H2O2)]2+,其原因是____ 。
(3)二氧化钛(TiO2)是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米TiO2催化的一个实例如图所示:
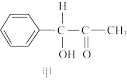
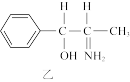
化合物乙中采取sp3方式杂化的原子对应的元素的第一电离能由大到小的顺序为____ 。化合物乙的分子中采取sp3杂化方式成键的原子数目是____ 个。
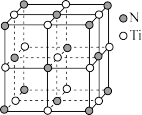
(4)氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为____ ,该晶体结构中与N原子距离最近且相等的N原子有____ 个;该晶胞的密度dg/cm3,则晶胞结构中两个氮原子之间的最近距离为____ 。(NA为阿伏加德罗常数的数值,1pm=10-12m,只列计算式)
(1)钛的核外电子排布式是
(2)钛元素的检验方法如图:

TiO2+可与H2O2形成配离子[TiO(H2O2)]2+,其原因是
(3)二氧化钛(TiO2)是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米TiO2催化的一个实例如图所示:


化合物乙中采取sp3方式杂化的原子对应的元素的第一电离能由大到小的顺序为
(4)氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为

您最近一年使用:0次
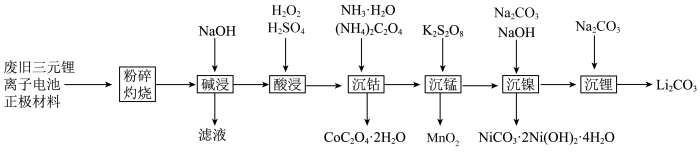
【推荐2】工业上一种利用废旧三元锂离子电池正极材料(主要成分为 ,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
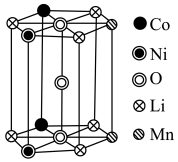
(1)钴位于元素周期表中_______ 区;基态锰原子的价电子排布图为_______ ;锂离子电池正极材料 的基本结构单元如图所示,则据此计算
的基本结构单元如图所示,则据此计算
_______ ,
_______ 。
(2)“粉碎灼烧”时可除去的杂质为_______ 。
(3)“碱浸”后滤液中大量存在的阴离子为_______ 和_______ 。
(4)已知: ,
, ,
, ,
, 。若“酸浸”后溶液中
。若“酸浸”后溶液中 、
、 、
、 浓度均为
浓度均为 ,理论计算欲使
,理论计算欲使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 )而不沉淀
)而不沉淀 、
、 ,需调节
,需调节 的范围为
的范围为_______ ;实际“沉钴”时,在加入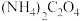 之前须先加入一定量氨水,推测所加氨水的作用为
之前须先加入一定量氨水,推测所加氨水的作用为_______ 。
(5)“沉锰”过程中加入 溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为
溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为_______ [用离子方程式表示,Mn(Ⅱ)写作Mn即可]。
(6)“沉镍”过程中加入 溶液不能过量,原因为
溶液不能过量,原因为_______ 。
 ,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
(1)钴位于元素周期表中
 的基本结构单元如图所示,则据此计算
的基本结构单元如图所示,则据此计算


(2)“粉碎灼烧”时可除去的杂质为
(3)“碱浸”后滤液中大量存在的阴离子为
(4)已知:
 ,
, ,
, ,
, 。若“酸浸”后溶液中
。若“酸浸”后溶液中 、
、 、
、 浓度均为
浓度均为 ,理论计算欲使
,理论计算欲使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 )而不沉淀
)而不沉淀 、
、 ,需调节
,需调节 的范围为
的范围为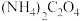 之前须先加入一定量氨水,推测所加氨水的作用为
之前须先加入一定量氨水,推测所加氨水的作用为(5)“沉锰”过程中加入
 溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为
溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为(6)“沉镍”过程中加入
 溶液不能过量,原因为
溶液不能过量,原因为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用___________ 上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图: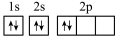 ,该电子排布图违背了
,该电子排布图违背了___________ ; 、
、 、
、 都是重要的有机反应中间体。
都是重要的有机反应中间体。 、
、 的空间构型分别为
的空间构型分别为___________ 、___________ 。
(3)基态溴原子的价层电子排布式为___________ ,第四周期中,与溴原子未成对电子数相同的金属元素有K、___________ 。(用元素符号列出全部)
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为___________ ,已知晶胞边长a pm,阿伏加德罗常数为 则磷化硼晶体的密度为
则磷化硼晶体的密度为___________ g/cm3。
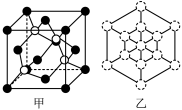
 磷化硼晶胞沿着体对角线方向的投影(图乙中
磷化硼晶胞沿着体对角线方向的投影(图乙中 表示P 原子的投影),用
表示P 原子的投影),用 画出B原子的投影位置
画出B原子的投影位置___________ 。
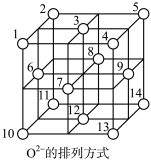
(5)如图丙所示Fe3O4晶体中, 围成正四面体空隙(
围成正四面体空隙( 、3、6、7号氧围成)和正八面体空隙(
、3、6、7号氧围成)和正八面体空隙( 、6、7、8、9、12号氧围成),
、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为
填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为___________ ,有___________  的正八面体空隙未填充阳离子。
的正八面体空隙未填充阳离子。
(1)现代化学中,常利用
(2)某同学画出基态碳原子的核外电子排布图:
 ,该电子排布图违背了
,该电子排布图违背了 、
、 、
、 都是重要的有机反应中间体。
都是重要的有机反应中间体。 、
、 的空间构型分别为
的空间构型分别为(3)基态溴原子的价层电子排布式为
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为 则磷化硼晶体的密度为
则磷化硼晶体的密度为
 磷化硼晶胞沿着体对角线方向的投影(图乙中
磷化硼晶胞沿着体对角线方向的投影(图乙中 表示P 原子的投影),用
表示P 原子的投影),用 画出B原子的投影位置
画出B原子的投影位置
(5)如图丙所示Fe3O4晶体中,
 围成正四面体空隙(
围成正四面体空隙( 、3、6、7号氧围成)和正八面体空隙(
、3、6、7号氧围成)和正八面体空隙( 、6、7、8、9、12号氧围成),
、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为
填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为 的正八面体空隙未填充阳离子。
的正八面体空隙未填充阳离子。
您最近一年使用:0次



