2024·上海·模拟预测
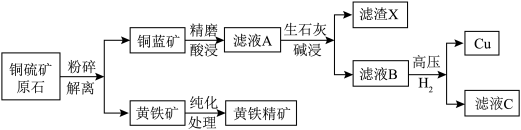
1 . 某铜硫矿富含黄铁矿和磁黄铁矿等硫铁矿物,占原矿矿物总量38%,实验室以此为原料模拟工业制备纯铜并利用黄铁精矿进行含铬废水处理,工艺流程转化如下:
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为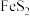 。
。
3.可能用到的数据如下:
(1)基态铜原子的空间运动状态为___________ 种。
(2)精磨酸浸过程中,精磨的作用是___________ ;酸浸一般选用硫酸溶液在纯氧环境中进行,酸浸的化学方程式为___________ 。
(3)已知增大氧气的浓度可以提高 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因___________ 。
(4)生石灰碱浸时调节pH的范围为___________。
(5)滤渣X的主要成分是___________ 。
(6)向滤液B中通入高压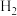 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是___________ 。
(7)黄铁精矿处理含铬废水的机理如图所示: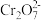 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:___________ 。
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为
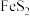 。
。3.可能用到的数据如下:
 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(2)精磨酸浸过程中,精磨的作用是
(3)已知增大氧气的浓度可以提高
 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因(4)生石灰碱浸时调节pH的范围为___________。
| A.3.2≤pH<4.7 | B.3.2≤pH<6.1 | C.4.2≤pH<6.7 | D.3.2≤pH<4.2 |
(6)向滤液B中通入高压
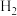 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是(7)黄铁精矿处理含铬废水的机理如图所示:
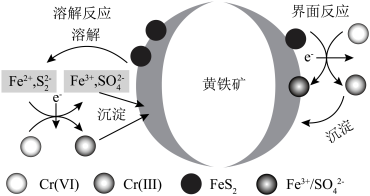
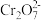 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
您最近一年使用:0次
解题方法
2 . 钛铁矿直接碳热还原法可以制得碳化钛。碳化钛在航空航天、机械加工等领域应用广泛。其晶胞结构与氯化钠相似,如图所示,晶胞的边长为anm。_____ 。
2.下列关于碳化钛的说法正确的是_____。
3.已知阿伏加德罗常数为NA,则碳化钛晶体的密度为_____ g·cm-3(列出计算式)。
4.由于晶体的不同晶面其原子排布的不同或者暴露的原子不同,导致所展现出的物理、化学性质会有所不同,这种现象成为晶面效应。若裸露的分别是A面、B面、C面,性能与另外两面不同的是_____ 。
A.A面 B.B面 C.C面
5.当TiC中的C原子被N原子取代时,则产生TiC1-xNx,其性能与x的值有关。随着x的增大,材料的硬度降低、韧性提高;同时x值会影响碳氮化钛的晶胞边长,x越大,则晶胞边长_____ 。
A.增大 B.减小 C.不变
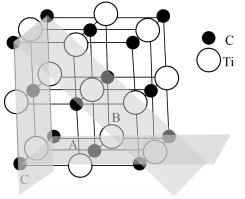
2.下列关于碳化钛的说法正确的是_____。
| A.碳化钛中碳和钛的比例为1∶1 |
| B.C原子位于Ti形成的四面体空隙中 |
| C.离Ti原子最近的且距离相等的C原子的数目为8 |
| D.碳化钛具有高熔点、高硬度的特点 |
4.由于晶体的不同晶面其原子排布的不同或者暴露的原子不同,导致所展现出的物理、化学性质会有所不同,这种现象成为晶面效应。若裸露的分别是A面、B面、C面,性能与另外两面不同的是
A.A面 B.B面 C.C面
5.当TiC中的C原子被N原子取代时,则产生TiC1-xNx,其性能与x的值有关。随着x的增大,材料的硬度降低、韧性提高;同时x值会影响碳氮化钛的晶胞边长,x越大,则晶胞边长
A.增大 B.减小 C.不变
您最近一年使用:0次
名校
解题方法
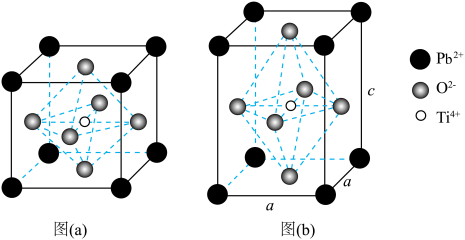
3 . 钛酸铅在光催化领域有很好的应用前景。以氨水、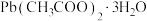 和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时,
和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时, 和
和 构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
(1)Ti原子有___________ 种运动状态不同的电子,其价电子排布式为___________ 。该元素位于___________ 区。
A.s B.p C.d D.f
(2)制备钛酸铅的原料[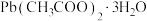 ]中,非金属元素的电负性由大到小的顺序为___________。
]中,非金属元素的电负性由大到小的顺序为___________。
(3)结合图(a)分析,立方钛酸铅的化学式为___________ 。
(4)四方钛酸铅[图(b)]中 周围最近的
周围最近的 数目为___________。
数目为___________。
(5)四方钛酸铅[图(b)]晶胞边长分别为 ,
, ,则该晶体的密度为
,则该晶体的密度为___________  。(计算结果保留2位小数,
。(计算结果保留2位小数, )
)
(6)二羟基双(乳酸铵)钛中负离子的结构为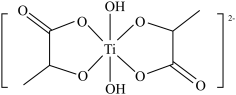 。
。
①二羟基双(乳酸铵)钛晶体中C原子杂化轨道类型为___________ 。
②二羟基双(乳酸铵)钛晶体类型为___________ 。
A.分子晶体 B.离子晶体 C.共价晶体 D.混合晶体
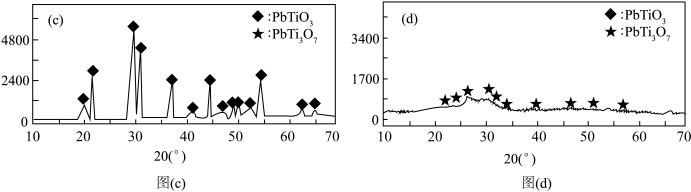
(7)晶体X射线衍射实验图谱会出现尖锐的峰。在制备钛酸铅时,分别向其中加入5 mL和20 mL二乙二醇X射线衍射实验图谱分别为图(c)和图(d),该图组说明在二乙二醇含量为20 mL时,___________ 形成晶态PbTiO3。
A.能 B.不能
 和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时,
和二羟基双(乳酸铵)钛为原料可制得钛酸铅晶体。其晶体结构如下图,高于490℃时,结构以图(a)形式存在;低于490℃时, 和
和 构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
构成的正八面体会沿着c轴被拉伸,结构以图(b)形式存在。
(1)Ti原子有
A.s B.p C.d D.f
(2)制备钛酸铅的原料[
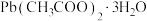 ]中,非金属元素的电负性由大到小的顺序为___________。
]中,非金属元素的电负性由大到小的顺序为___________。| A.C>H>O | B.O>H>C | C.O>C>H | D.H>O>C |
(3)结合图(a)分析,立方钛酸铅的化学式为
(4)四方钛酸铅[图(b)]中
 周围最近的
周围最近的 数目为___________。
数目为___________。| A.2 | B.4 | C.6 | D.8 |
(5)四方钛酸铅[图(b)]晶胞边长分别为
 ,
, ,则该晶体的密度为
,则该晶体的密度为 。(计算结果保留2位小数,
。(计算结果保留2位小数, )
)(6)二羟基双(乳酸铵)钛中负离子的结构为
 。
。①二羟基双(乳酸铵)钛晶体中C原子杂化轨道类型为
②二羟基双(乳酸铵)钛晶体类型为
A.分子晶体 B.离子晶体 C.共价晶体 D.混合晶体
(7)晶体X射线衍射实验图谱会出现尖锐的峰。在制备钛酸铅时,分别向其中加入5 mL和20 mL二乙二醇X射线衍射实验图谱分别为图(c)和图(d),该图组说明在二乙二醇含量为20 mL时,
A.能 B.不能

您最近一年使用:0次
解题方法
4 . 铬属于过渡元素,三价铬离子能形成多种配位化合物,例如: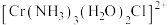 。
。
(1)对于基态Cr原子,下列叙述正确的是___________ 。
A.铬位于周期表的第四周期ⅥB族
B.铬核外电子排布式为
C.4s轨道上电子能量大于3d
(2) 中提供电子对形成配位键的原子或离子是
中提供电子对形成配位键的原子或离子是___________ ,中心离子的配位数为___________ 。
(3) 中基态Cl原子核外电子的运动状态有___________种。
中基态Cl原子核外电子的运动状态有___________种。
(4) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
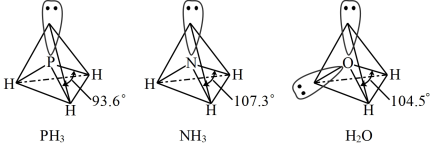
① 的中心原子的杂化类型是
的中心原子的杂化类型是___________ 。
A.sp B.sp2 C.sp3
 分子的空间构型是
分子的空间构型是___________ 。
A.直线形 B.平面三角形 C.三角锥形 D.正四面体形
② 的沸点比
的沸点比 的高,原因是
的高,原因是___________ 。
③ 的键角小于
的键角小于 ,原因是
,原因是___________ 。
(5)①铬的一种氮化物晶体立方晶胞结构如下图所示,每个晶胞中平均分摊___________个Cr3+,___________个N3-。______
a.1 1 B.4 3 C.4 4 D.14 13
②若晶胞参数为a nm,计算晶体密度ρ =___________ g·cm-3(阿伏加德罗常数的值为NA)。

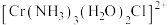 。
。(1)对于基态Cr原子,下列叙述正确的是
A.铬位于周期表的第四周期ⅥB族
B.铬核外电子排布式为

C.4s轨道上电子能量大于3d
(2)
 中提供电子对形成配位键的原子或离子是
中提供电子对形成配位键的原子或离子是(3)
 中基态Cl原子核外电子的运动状态有___________种。
中基态Cl原子核外电子的运动状态有___________种。| A.2 | B.5 | C.7 | D.17 |
(4)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
①
 的中心原子的杂化类型是
的中心原子的杂化类型是A.sp B.sp2 C.sp3
 分子的空间构型是
分子的空间构型是A.直线形 B.平面三角形 C.三角锥形 D.正四面体形
②
 的沸点比
的沸点比 的高,原因是
的高,原因是③
 的键角小于
的键角小于 ,原因是
,原因是(5)①铬的一种氮化物晶体立方晶胞结构如下图所示,每个晶胞中平均分摊___________个Cr3+,___________个N3-。
a.1 1 B.4 3 C.4 4 D.14 13
②若晶胞参数为a nm,计算晶体密度ρ =

您最近一年使用:0次
名校
解题方法
5 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中, 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
名校
6 . 钒(23V)广泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
(1)基态钒原子的价电子排布式为___________ ,与钒同周期的所有元素的基态原子中,未成对电子数最多的是___________ (填元素符号)。
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知 空间构型与
空间构型与 相同。
相同。
① 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为______ 。
A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与 空间构型相同的正离子有
空间构型相同的正离子有______ (任写一种)。
(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为______ mol·L-1(用含 a、b 的代数式表示)。
②这段时间内用 O2 表示的平均化学反应速率为______ mol/(L·min)-1(用含 a、b、t的代数式表示)。
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中______ 。

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。
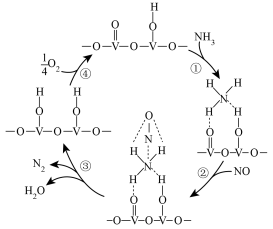
①上述历程中,钒元素被氧化的过程有______ (填序号);写出总反应的化学方程式:___________ 。
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:___________ 。

(1)基态钒原子的价电子排布式为
(2)V2O5 溶解在 NaOH 溶液中,可得到钒酸钠(Na3VO4),已知
 空间构型与
空间构型与 相同。
相同。①
 中心原子价层孤电子对数目为
中心原子价层孤电子对数目为A.0 B.1 C.2 D.3
②短周期元素形成的各微粒中,与
 空间构型相同的正离子有
空间构型相同的正离子有(3)V2O5 常用作 SO2 转化为 SO3 的催化剂。一定条件下,在固定容积的密闭容器中充入 SO2与空气的混合气体,加入一定量 V2O5,反应 t min 后,容器中 SO2 和 SO3 物质的量浓度分别为 a mol·L-1 和 b mol·L-1。
①SO2 起始物质的量浓度为
②这段时间内用 O2 表示的平均化学反应速率为
③在未使用催化剂时,SO2 氧化反应的能量变化如图所示。加入 V2O5 后,会使图中

A.E1 增大、E3 减小 B.E1减小、E2增大
C.E2 减小、E3不变 D.E2减小、E3 增大
(4)用活化后的 V2O5 作催化剂,在有氧条件下氨气将 NO 还原成 N2 的一种反应历程如图所示。

①上述历程中,钒元素被氧化的过程有
②按上述图中 NH3、NO 和 O2 的比例进行催化脱硝反应。反应一定的时间,NH3 和 NO 的转化率与温度的关系如图所示。超过 200℃后,NO 转化率急剧下降,而 NH3 仍维持较高,原因可能是:

您最近一年使用:0次
名校
解题方法
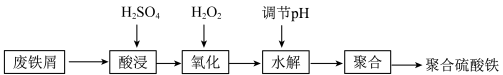
7 . 无机净水剂主要有铁系和铝系两类,但铝对人体有慢性毒害作用,所以研制各种铁系净水剂成为热门。聚合硫酸铁 是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
(1)Fe原子价电子排布式为_____ 。
(2)清洗废铁屑表面的油污可选用热的纯碱溶液,请用离子方程式表示纯碱溶液显碱性的原因:_____ 。
(3)“氧化”步骤中发生反应的离子方程式为:
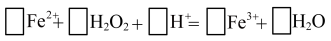
配平上述反应,并标出电子转移方向和数目_____ (在答题卡上画出 )
(4)保持温度不变,向硫酸铁溶液中加入少量的NaOH固体,下列说法正确的是_____(不定项)
(5)“水解”步骤中溶液的pH必须控制在一定的范围内,原因是_____ 。
(6)研究表明, 在水解的过程当中会产生
在水解的过程当中会产生 、
、 等产物,请写出
等产物,请写出 水解产生
水解产生 的离子方程式:
的离子方程式:_____ 。
聚合硫酸铁中 比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入
比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入 溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
(7)聚合硫酸铁中
_____ 。
 是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
是一种常用的净水剂,下图是以废铁屑为原料制备聚合硫酸铁的一种工艺流程。
(1)Fe原子价电子排布式为
(2)清洗废铁屑表面的油污可选用热的纯碱溶液,请用离子方程式表示纯碱溶液显碱性的原因:
(3)“氧化”步骤中发生反应的离子方程式为:
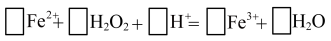
配平上述反应,并标出电子转移方向和数目
(4)保持温度不变,向硫酸铁溶液中加入少量的NaOH固体,下列说法正确的是_____(不定项)
A. 水解程度增大 水解程度增大 | B.溶液pH减小 |
C. 减小 减小 | D.水的电离程度增大 |
(6)研究表明,
 在水解的过程当中会产生
在水解的过程当中会产生 、
、 等产物,请写出
等产物,请写出 水解产生
水解产生 的离子方程式:
的离子方程式:聚合硫酸铁中
 比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入
比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化,然后加入 溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。
溶液,经过滤后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为2.33g向滤液B中加入足量的NaOH溶液充分反应,将经过滤后得到的滤渣洗涤、灼烧至恒重,得1.60g固体C。(7)聚合硫酸铁中

您最近一年使用:0次
名校
解题方法
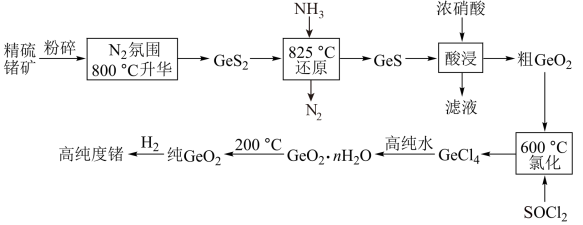
8 . 门捷列夫最早预言了具有半导体特性类硅元素锗(32Ge),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
② 在
在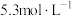 的盐酸中溶解度最小。
的盐酸中溶解度最小。
(1)基态锗原子的价层电子排布式为___________ ,晶体锗的晶体类型是___________ 。
(2)① ,使精硫锗矿在
,使精硫锗矿在 氛围中升华的原因是
氛围中升华的原因是___________ 。
②还原时发生反应:___________ ___________
___________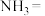 ___________
___________ ___________
___________ ___________
___________ 。配平上述反应的化学方程式,标出电子转移的方向和数目
。配平上述反应的化学方程式,标出电子转移的方向和数目______________ 。
③比较键角:
___________  (选填编号)。其原因是
(选填编号)。其原因是___________ 。
A.> B.< C.=
(3)酸浸时温度不能过高的原因是___________ 。氯化除生成 外,反应还生成一种V形分子,相应的化学方程式为
外,反应还生成一种V形分子,相应的化学方程式为___________ 。 水解得到
水解得到 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是___________ 。
(4) 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②
 在
在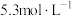 的盐酸中溶解度最小。
的盐酸中溶解度最小。(1)基态锗原子的价层电子排布式为
(2)①
 ,使精硫锗矿在
,使精硫锗矿在 氛围中升华的原因是
氛围中升华的原因是②还原时发生反应:___________
 ___________
___________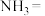 ___________
___________ ___________
___________ ___________
___________ 。配平上述反应的化学方程式,标出电子转移的方向和数目
。配平上述反应的化学方程式,标出电子转移的方向和数目③比较键角:

 (选填编号)。其原因是
(选填编号)。其原因是A.> B.< C.=
(3)酸浸时温度不能过高的原因是
 外,反应还生成一种V形分子,相应的化学方程式为
外,反应还生成一种V形分子,相应的化学方程式为 水解得到
水解得到 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是(4)
 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
A.n点与p点对应的 相等 相等 |
B.q点无 沉淀生成 沉淀生成 |
| C.通过蒸发可以使溶液由q点变到p点 |
D.加入 可以使溶液由n点变到m点 可以使溶液由n点变到m点 |
您最近一年使用:0次
名校
解题方法
9 . 细菌可以促使氮、铁两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。

(1)N的原子结构示意图是_______ ,核外有_______ 种不同运动状态的电子;Fe原子的价层电子排布式为_______ ,这些价层电子共占据_______ 个轨道。
(2)实验室中检验NH 的方法是
的方法是_______ 。
(3)上图所示氮循环中,属于氮的固定的过程为有_______。
(4)硝化过程中,含氮物质发生_______ (选填“氧化”或“还原”)反应。
(5)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮的反应如下,配平该反应方程式_______ 。

(6)下列溶液中分别加入足量的铁粉,充分作用后,溶液中的正离子总物质的量明显减少,该溶液是_______。
(7)已知常温时,醋酸、亚硝酸的电离常数分别为1.77×10-5和5.1×10-4,醋酸铵溶液呈中性。据此判断,亚硝酸铵溶液呈_______ (选填“酸”、“碱”或“中”)性,其溶液中各离子浓度由大到小的顺序为_______ 。

(1)N的原子结构示意图是
(2)实验室中检验NH
 的方法是
的方法是(3)上图所示氮循环中,属于氮的固定的过程为有_______。
| A.N2转化为铵态氮 | B.硝化过程 |
C.NH 在Fe3+作用下转化为N2 在Fe3+作用下转化为N2 | D.反硝化过程 |
(4)硝化过程中,含氮物质发生
(5)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮的反应如下,配平该反应方程式

(6)下列溶液中分别加入足量的铁粉,充分作用后,溶液中的正离子总物质的量明显减少,该溶液是_______。
| A.CuCl2 | B.HCl | C.FeCl3 | D.MgCl2 |
(7)已知常温时,醋酸、亚硝酸的电离常数分别为1.77×10-5和5.1×10-4,醋酸铵溶液呈中性。据此判断,亚硝酸铵溶液呈
您最近一年使用:0次
10 . 地壳中各种物质存在各种转化,如金属铜的硫化物经生物氧化会转化为 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
A.工业上可用 处理含有 处理含有 、 、 等金属硫化物的废水 等金属硫化物的废水 |
B.当溶液中有 和 和 共存时,溶液中 共存时,溶液中 |
C.基态 的价电子排布式为 的价电子排布式为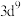 |
D. 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 |
您最近一年使用:0次
2023-05-21更新
|
142次组卷
|
3卷引用:上海市宜川中学2023-2024学年高三上学期10月月考化学试卷



