1 . 研究人员发现在某种含钒催化剂的作用下,NO可被 还原为
还原为 ,从而降低含氮气体造成的空气污染,反应机理如图所示,下列说法错误的是
,从而降低含氮气体造成的空气污染,反应机理如图所示,下列说法错误的是
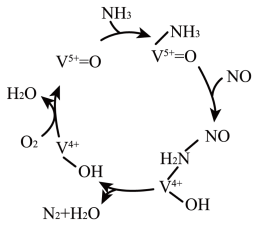
 还原为
还原为 ,从而降低含氮气体造成的空气污染,反应机理如图所示,下列说法错误的是
,从而降低含氮气体造成的空气污染,反应机理如图所示,下列说法错误的是
A.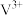 价电子排布式为 价电子排布式为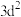 ,未成对电子数是2 ,未成对电子数是2 |
B. 和NO分子是极性分子, 和NO分子是极性分子, 为该反应的中间体 为该反应的中间体 |
| C.该转化过程中,氧化剂只有NO |
D.每生成标准状况下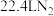 ,转移电子总数为 ,转移电子总数为 |
您最近一年使用:0次
2 .  是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。 时各物质溶度积见下表:
时各物质溶度积见下表:
回答下列问题:
(1) 中
中 元素的化合价是
元素的化合价是 和
和_______ 。 的核外电子排布式为
的核外电子排布式为_______ 。
(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是_______ 。
(3)反应釜2中,加入 和分散剂的同时通入空气。
和分散剂的同时通入空气。
①反应的离子方程式为_______ 。
②为加快反应速率,可采取的措施有_______ 。(写出两项即可)。
(4)①反应釜3中, 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过_______ 。
②称取 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为_______ ,该副产物中 的质量分数为
的质量分数为_______ 。
 是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。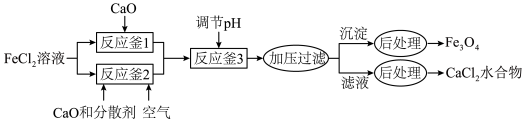
 时各物质溶度积见下表:
时各物质溶度积见下表:| 物质 |  |  |  |
溶度积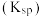 |  |  |  |
(1)
 中
中 元素的化合价是
元素的化合价是 和
和 的核外电子排布式为
的核外电子排布式为(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是
(3)反应釜2中,加入
 和分散剂的同时通入空气。
和分散剂的同时通入空气。①反应的离子方程式为
②为加快反应速率,可采取的措施有
(4)①反应釜3中,
 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过②称取
 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为 的质量分数为
的质量分数为
您最近一年使用:0次
2023-09-28更新
|
4602次组卷
|
5卷引用:新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷
名校
解题方法
3 . 硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如图所示。

回答下列问题:
(1)NaBH4中含有的化学键为_________________ 、_________________ 。
(2)Fe3+的核外电子排布式_____________________________ 。
(3)碱溶过滤得滤渣的主要成分是______________ 、_______________ 。
(4)写出Na2B4O7制取NaBH4的化学方程式____________________________ 。
(5)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,写出阴极反应的电极方程式______________________ 。

(6)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,7.6g NaBH4的还原能力相当于_____________ g H2的还原能力。

回答下列问题:
(1)NaBH4中含有的化学键为
(2)Fe3+的核外电子排布式
(3)碱溶过滤得滤渣的主要成分是
(4)写出Na2B4O7制取NaBH4的化学方程式
(5)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,写出阴极反应的电极方程式

(6)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,7.6g NaBH4的还原能力相当于
您最近一年使用:0次
2023-04-12更新
|
133次组卷
|
2卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三上学期1月月考化学试题
4 . 下表标出的是元素周期表的一部分元素,回答下列问题:

(1)第三周期中原子半径最小的是___________ 。(用元素符号表示)
(2)表中用字母标出的15种元素中,化学性质最不活泼的是___________ (用元素符号表示),金属性最强的是___________ ,(用元素符号表示)非金属性最强的是___________ ,(用元素符号表示)属于过渡元素的是___________ (用字母表示)。
(3)d,e,f气态氢化物最稳定的为___________ , 最不稳定的为___________ 。(填化学式)
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为___________ ,其价电子排布式为___________ 。
(5)请画出26号元素其价电子排布图:___________ 。
(6)d与a反应的产物的分子中心原子的杂化形式为___________ ,该分子是___________ (填“极性”或“非极性”)分子。
(7)写出铜元素在周期表中的位置___________ ,它位于___________ 区。并写出Cu+ 基态电子排布式___________ 。
(8)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态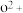 再失去一个电子比气态
再失去一个电子比气态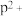 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________
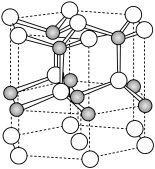
(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。
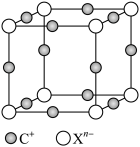
该晶体中阳离子和阴离子个数比为___________ ,晶体中每个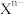 被
被___________ 个等距离的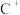 包围。
包围。

(1)第三周期中原子半径最小的是
(2)表中用字母标出的15种元素中,化学性质最不活泼的是
(3)d,e,f气态氢化物最稳定的为
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为
(5)请画出26号元素其价电子排布图:
(6)d与a反应的产物的分子中心原子的杂化形式为
(7)写出铜元素在周期表中的位置
(8)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
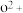 再失去一个电子比气态
再失去一个电子比气态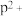 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。

该晶体中阳离子和阴离子个数比为
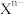 被
被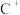 包围。
包围。
您最近一年使用:0次
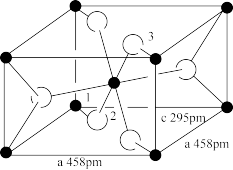
5 . 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为_______ 。元素X、Y、Z的第一电离能由小到大顺序是_______ (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为_______ (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为_______ 。
(4)YH3极易溶于水的主要原因是_______ 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是_______ 、_______ 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是_______ 。根据价层电子对互斥理论推测NO 的空间构型为
的空间构型为_______ 。
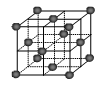
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如上图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有_______ 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是_______ 。
(7)金刚石晶体

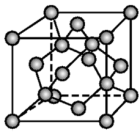
①晶体中碳原子个数与C-C键数之比为_______ ,在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为_______ 。
②干冰、金刚石、硅熔点高低顺序为:_______ ,原因:_______ 。
(1)W基态原子的价电子排布式为
(2)与XYZ-互为等电子体的一种分子为
(3)1 mol H2XZ3分子中含有σ键的数目为
(4)YH3极易溶于水的主要原因是
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是
 的空间构型为
的空间构型为
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如上图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是
(7)金刚石晶体


①晶体中碳原子个数与C-C键数之比为
②干冰、金刚石、硅熔点高低顺序为:
您最近一年使用:0次
名校
解题方法
6 . 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的py原子轨道上的电子数为_______ 个。 与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较大的是_______ (写 元素符号)。。
(2)Ti的配合物有多种。在Ti(CO)6、T(H2O) 和TiF
和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是_______ (写元素符号), Ti(H2O) 中∠H-O-H
中∠H-O-H_______ (填大于、小于或等于)单个水分子中∠H-O-H,原因为_______ ; Ti(NO3)4的球棍结构如图,Ti 的配位数是_______ ,N原子的杂化方式为_______ , 与NO 互为等电子体的分子为
互为等电子体的分子为_______ (写分子式)
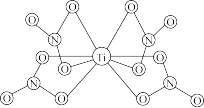
(3)钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2,如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为_______ ; 设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。
(1)基态钛原子的py原子轨道上的电子数为
(2)Ti的配合物有多种。在Ti(CO)6、T(H2O)
 和TiF
和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中∠H-O-H
中∠H-O-H 互为等电子体的分子为
互为等电子体的分子为
(3)钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2,如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为

您最近一年使用:0次
2022-05-03更新
|
1298次组卷
|
3卷引用:新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题
新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题福建省连城县第一中学2022-2023学年高三上学期暑期月考化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题
解题方法
7 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
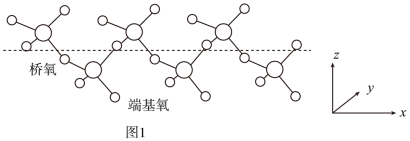
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
(4)噻吩( )、吡咯(
)、吡咯(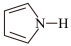 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
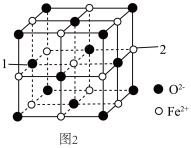
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
333次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市2021届高三第二次质量检测理综化学试题
名校
解题方法
8 . 碳族元素与氮族元素的单质及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Ge原子价电子排布式为___________ 。
(2)C、N、O、Si第一电离能由大到小的顺序为___________ ;
(3)已知N2O与CO2互为等电子体,则N2O的结构式为___________ ,N2O是___________ (填“极性”或“非极性”)分子。
(4)磷能形成多种含氧酸,其中亚磷酸的结构如为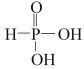 ,则Na2HPO3溶液中各离子浓度由大到小的顺序为
,则Na2HPO3溶液中各离子浓度由大到小的顺序为___________ 。
(5)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:
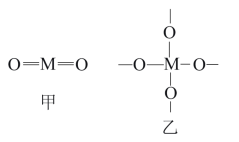
部分化学键的键能如表所示:
SiO2晶体中Si原子采取的构型是___________ (填“甲”或“乙”),从能量角度解释Si原子采取该构型的原因是___________ 。
(6)碳化硅(SiC)是人工合成的无机非金属材料,其晶体结构类似于金刚石,结构如图所示:
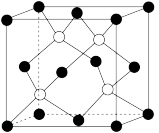
①该晶体中碳原子的杂化轨道类型为_______ 杂化,一个硅原子周围与其最近的硅原子的数目为________ 。
②在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是___ 。
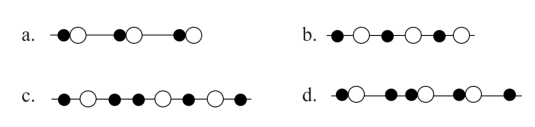
③如果SiC晶体中硅原子与最近碳原子间距离为dpm,则SiC晶体的密度为______ g·cm-3(写含有d的表达式)
(1)基态Ge原子价电子排布式为
(2)C、N、O、Si第一电离能由大到小的顺序为
(3)已知N2O与CO2互为等电子体,则N2O的结构式为
(4)磷能形成多种含氧酸,其中亚磷酸的结构如为
 ,则Na2HPO3溶液中各离子浓度由大到小的顺序为
,则Na2HPO3溶液中各离子浓度由大到小的顺序为(5)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
| 化学键 | 键能/(kJ·mol-1) | 化学键 | 键能/(kJ·mol-1) | |
| C—C | 331 | C—O | 343 | |
| Si—Si | 197 | Si—O | 466 | |
| C=C | 620 | CO | 805 | |
| Si=Si | 272 | Si=O | 640 |
(6)碳化硅(SiC)是人工合成的无机非金属材料,其晶体结构类似于金刚石,结构如图所示:

①该晶体中碳原子的杂化轨道类型为
②在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是
③如果SiC晶体中硅原子与最近碳原子间距离为dpm,则SiC晶体的密度为
您最近一年使用:0次
2022-03-16更新
|
230次组卷
|
2卷引用:新疆和田地区皮山县2022-2023学年高三上学期11月期中考试化学试题
解题方法
9 . 锌及锌的化合物应用广泛。测定铜合金中的铅、锌时要利用下列反应: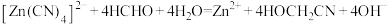 回答下列问题:
回答下列问题:
(1)基态Zn2+的电子排布式为_______ ,基态C原子核外电子占据_______ 个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_______ ,HOCH2CN分子中含有的 键与
键与 键数目之比为
键数目之比为_______ 。
(3)HCHO分子中碳原子轨道的杂化类型是___ ,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是___ 。
(4) 中Zn2+与CN-之间的化学键称为
中Zn2+与CN-之间的化学键称为____ ,CN-的电子式为_____ 。
(5)ZnO的一种最稳定的晶体结构如图所示,晶胞中Zn2+的配位数为_______ 。六棱柱底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则ZnO的密度为_______ g∙cm-3(列出计算表达式)。
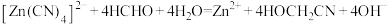 回答下列问题:
回答下列问题:(1)基态Zn2+的电子排布式为
(2)C、N、O三种元素的第一电离能由大到小的顺序为
 键与
键与 键数目之比为
键数目之比为(3)HCHO分子中碳原子轨道的杂化类型是
(4)
 中Zn2+与CN-之间的化学键称为
中Zn2+与CN-之间的化学键称为(5)ZnO的一种最稳定的晶体结构如图所示,晶胞中Zn2+的配位数为

您最近一年使用:0次
名校
解题方法
10 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题(注意:答题时A、B、C、D、E用所对应的元素符号表示):
(1)A、B、C、D四种元素电负性由大到小排列顺序为____ 。
(2)B的氢化物的结构式是____ ,其空间构型为____ 。
(3)E核外电子排布式是____ ,E的某种化合物的结构如图所示。微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____ 。
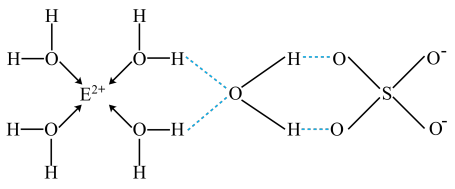
(4)A与B的气态氢化物相比,沸点更高的是____ (填化学式);
(5)A的稳定氧化物中,中心原子的杂化类型为____ ,空间构型为____ 。
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)B的氢化物的结构式是
(3)E核外电子排布式是
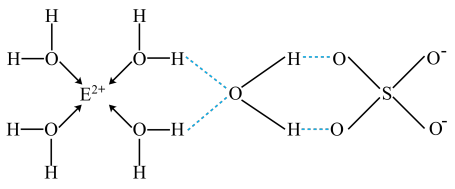
(4)A与B的气态氢化物相比,沸点更高的是
(5)A的稳定氧化物中,中心原子的杂化类型为
您最近一年使用:0次
2020-05-22更新
|
74次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学 2022-2023学年高三下学期2月月考化学试题



