1 . 某工厂废渣的主要成分为ZnO、PbO、 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是___________ (填分子式),该气体的用途是___________ (填一条)。
(2)“氨浸”所得滤液1中的阳离子主要成分为 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是___________ ,“沉铜”时发生反应的离子方程式为___________ 。
(3)“滤渣4”的主要成分为___________ (填化学式)。
(4)“滤液3”的主要溶质为 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为___________ 。
(5)“转化”时生成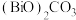 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为___________ 。
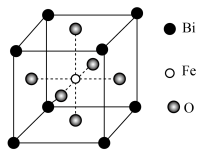
(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。___________ 。
②该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是
(2)“氨浸”所得滤液1中的阳离子主要成分为
 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是(3)“滤渣4”的主要成分为
(4)“滤液3”的主要溶质为
 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为(5)“转化”时生成
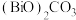 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。
②该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
2 . 自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)下列有关微粒性质的排列顺序错误的是___________。
(2)基态Cu原子核外电子运动状态有___________ 种,其核外电子排布式中未成对电子数为___________ 个。
(3)钌(Ru)一多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(Ⅱ)的配位数是___________ ,N原子的杂化类型为___________ 。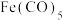 、
、 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时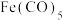 为浅黄色液体,沸点103℃,则
为浅黄色液体,沸点103℃,则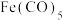 中含有的化学键类型包括___________(填字母)。
中含有的化学键类型包括___________(填字母)。
(5) 比
比 更稳定的原因是
更稳定的原因是___________ 。
(1)下列有关微粒性质的排列顺序错误的是___________。
| A.元素的电负性:P<O<F | B.元素的第一电离能:C<N<O |
C.离子半径: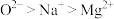 | D.原子的未成对电子数:Mn>Si>Cl |
(2)基态Cu原子核外电子运动状态有
(3)钌(Ru)一多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(Ⅱ)的配位数是

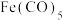 、
、 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时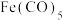 为浅黄色液体,沸点103℃,则
为浅黄色液体,沸点103℃,则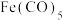 中含有的化学键类型包括___________(填字母)。
中含有的化学键类型包括___________(填字母)。| A.极性共价键 | B.离子键 | C.配位键 | D.金属键 |
(5)
 比
比 更稳定的原因是
更稳定的原因是
您最近一年使用:0次
3 . 向盛有 溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色透明溶液。再向该溶液中加入一定量乙醇并用玻璃棒摩擦试管壁,析出深蓝色晶体。下列有关说法错误的是
溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色透明溶液。再向该溶液中加入一定量乙醇并用玻璃棒摩擦试管壁,析出深蓝色晶体。下列有关说法错误的是
 溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色透明溶液。再向该溶液中加入一定量乙醇并用玻璃棒摩擦试管壁,析出深蓝色晶体。下列有关说法错误的是
溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色透明溶液。再向该溶液中加入一定量乙醇并用玻璃棒摩擦试管壁,析出深蓝色晶体。下列有关说法错误的是A.用玻璃棒摩擦试管壁的作用是使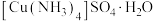 尽快结晶 尽快结晶 |
B.氨水是弱电解质,电离的方程式为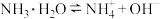 |
C.深蓝色是由于存在 ,其中 ,其中 提供空轨道,N原子提供孤电子对 提供空轨道,N原子提供孤电子对 |
D.难溶物溶解且得到深蓝色透明溶液的反应: |
您最近一年使用:0次
4 . 镁、铝及其合金是中学常见金属材料,被广泛应用于生产生活中。回答下列问题:
(1)B、Al、Ga、In、Tl为同一主族从上至下的相邻元素,则Tl元素的价层电子排布式为___________ 。
(2)金属铝的冶炼过程中常需要冰晶石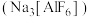 作助熔剂,已知冰晶石可通过下列原理制备:
作助熔剂,已知冰晶石可通过下列原理制备:
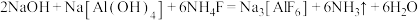 。
。
①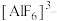 中Al的杂化类型为
中Al的杂化类型为___________ (填选项字母)。
A. B.
B. C.
C. D.
D.
②冰晶石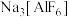 的熔点为1000℃左右,高于NaOH的熔点(318℃)的原因为
的熔点为1000℃左右,高于NaOH的熔点(318℃)的原因为___________ 。
(3)铝硫电池常用熔融氯铝酸盐(由NaCl、KCl和 形成熔点为93℃的共熔物)作电解质,在放电和充电过程中氯铝酸根起到结合或释放
形成熔点为93℃的共熔物)作电解质,在放电和充电过程中氯铝酸根起到结合或释放 的作用。图甲为初始状态共熔物中铝元素的存在形式,放电时
的作用。图甲为初始状态共熔物中铝元素的存在形式,放电时 会进入到电解质中并结合游离的
会进入到电解质中并结合游离的 和
和 形成有限长单链聚合体(如图乙),则该单链聚合体的化学式为
形成有限长单链聚合体(如图乙),则该单链聚合体的化学式为___________ (Al的数目用n表示)。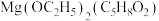 是用于制备纳米级MgO粉体的重要原料,可通过乙醇、乙酰丙酮(
是用于制备纳米级MgO粉体的重要原料,可通过乙醇、乙酰丙酮( )与Mg在一定条件下反应合成,其结构简式如图丙所示。
)与Mg在一定条件下反应合成,其结构简式如图丙所示。___________ ,氧原子提供孤对电子与镁形成___________ 键。
②乙醇镁配合物中,各元素电负性由大到小的顺序为___________ 。
③乙醇的沸点高于乙酰丙酮的原因为___________ 。
(5)已知 晶体存在两种晶胞结构,如图丁所示。该晶胞参数
晶体存在两种晶胞结构,如图丁所示。该晶胞参数 ,阿伏加德罗常数的值以
,阿伏加德罗常数的值以 表示。
表示。 的配位数之比为a:b=
的配位数之比为a:b=___________ 。
②晶胞b中两个最近的 间的距离为x nm,该晶体的密度为
间的距离为x nm,该晶体的密度为___________  。
。
(1)B、Al、Ga、In、Tl为同一主族从上至下的相邻元素,则Tl元素的价层电子排布式为
(2)金属铝的冶炼过程中常需要冰晶石
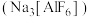 作助熔剂,已知冰晶石可通过下列原理制备:
作助熔剂,已知冰晶石可通过下列原理制备: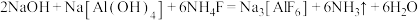 。
。①
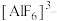 中Al的杂化类型为
中Al的杂化类型为A.
 B.
B. C.
C. D.
D.
②冰晶石
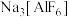 的熔点为1000℃左右,高于NaOH的熔点(318℃)的原因为
的熔点为1000℃左右,高于NaOH的熔点(318℃)的原因为(3)铝硫电池常用熔融氯铝酸盐(由NaCl、KCl和
 形成熔点为93℃的共熔物)作电解质,在放电和充电过程中氯铝酸根起到结合或释放
形成熔点为93℃的共熔物)作电解质,在放电和充电过程中氯铝酸根起到结合或释放 的作用。图甲为初始状态共熔物中铝元素的存在形式,放电时
的作用。图甲为初始状态共熔物中铝元素的存在形式,放电时 会进入到电解质中并结合游离的
会进入到电解质中并结合游离的 和
和 形成有限长单链聚合体(如图乙),则该单链聚合体的化学式为
形成有限长单链聚合体(如图乙),则该单链聚合体的化学式为
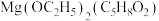 是用于制备纳米级MgO粉体的重要原料,可通过乙醇、乙酰丙酮(
是用于制备纳米级MgO粉体的重要原料,可通过乙醇、乙酰丙酮( )与Mg在一定条件下反应合成,其结构简式如图丙所示。
)与Mg在一定条件下反应合成,其结构简式如图丙所示。
②乙醇镁配合物中,各元素电负性由大到小的顺序为
③乙醇的沸点高于乙酰丙酮的原因为
(5)已知
 晶体存在两种晶胞结构,如图丁所示。该晶胞参数
晶体存在两种晶胞结构,如图丁所示。该晶胞参数 ,阿伏加德罗常数的值以
,阿伏加德罗常数的值以 表示。
表示。
 的配位数之比为a:b=
的配位数之比为a:b=②晶胞b中两个最近的
 间的距离为x nm,该晶体的密度为
间的距离为x nm,该晶体的密度为 。
。
您最近一年使用:0次
5 . 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知 ,用
,用 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
 ,用
,用 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
A.基态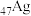 失去4d能级上的一个电子转化为 失去4d能级上的一个电子转化为 |
B.若N点原子分数坐标为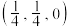 ,则P点原子分数坐标为 ,则P点原子分数坐标为 |
C.M、N之间的距离为 |
D.晶体的密度为 |
您最近一年使用:0次
6 . 氧化钪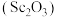 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪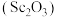 的一种流程如下图。
的一种流程如下图。

回答下列问题:
(1)基态钪原子的价层电子排布式为___________ 。
(2)“萃取”时,钛白工业废酸中加入 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的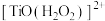 ,其中钛的化合价为
,其中钛的化合价为___________ ; 的作用是
的作用是___________ (填标号)。
A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将 试剂沿烧杯内壁缓慢注入
试剂沿烧杯内壁缓慢注入 试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入
试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入 试剂中,并不断搅拌,则A、C分别对应上述试剂中的
试剂中,并不断搅拌,则A、C分别对应上述试剂中的___________ 、___________ 。
(4)萃取剂萃取 的原理为
的原理为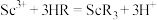 (
( 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成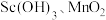 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为___________ 。 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为___________  (已知:
(已知: 时,
时,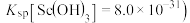 。
。
(5)“沉钪”时用到草酸。已知草酸的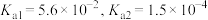 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中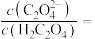
___________ 。
(6)在空气中焙烧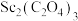 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为___________ 。
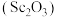 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪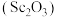 的一种流程如下图。
的一种流程如下图。
回答下列问题:
(1)基态钪原子的价层电子排布式为
(2)“萃取”时,钛白工业废酸中加入
 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的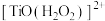 ,其中钛的化合价为
,其中钛的化合价为 的作用是
的作用是A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用
 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将 试剂沿烧杯内壁缓慢注入
试剂沿烧杯内壁缓慢注入 试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入
试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入 试剂中,并不断搅拌,则A、C分别对应上述试剂中的
试剂中,并不断搅拌,则A、C分别对应上述试剂中的(4)萃取剂萃取
 的原理为
的原理为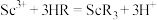 (
( 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成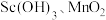 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为 (已知:
(已知: 时,
时,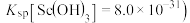 。
。(5)“沉钪”时用到草酸。已知草酸的
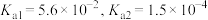 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中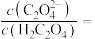
(6)在空气中焙烧
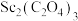 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为
您最近一年使用:0次
解题方法
7 . 钯(Pd)是航天、航空等高科技领域不可缺少的关键材料。一种从铂钯精矿[含有Pt、Pd、Au、Cu、Bi]中分离提取钯的工艺流程如图所示:
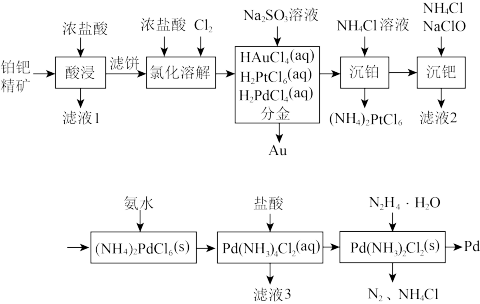
(1)“滤液1”中含有 和
和 ,
, 中Cu的化合价为
中Cu的化合价为________ ;Bi与As在周期表中位于同一主族,基态As原子的简化电子排布式为________ 。
(2)“氯化溶解”时氯气的作用是_________ 。
(3)“分金”时, 的氧化性
的氧化性____ (填“大于”或“小于”) ,理由是
,理由是_____ 。
(4)“沉铂”时发生反应的化学方程式为_________ 。
(5)“沉钯”时反应的化学方程式为___________ 。“滤液3”可以进入到________ 中循环利用。
(6) (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为________ 。

(1)“滤液1”中含有
 和
和 ,
, 中Cu的化合价为
中Cu的化合价为(2)“氯化溶解”时氯气的作用是
(3)“分金”时,
 的氧化性
的氧化性 ,理由是
,理由是(4)“沉铂”时发生反应的化学方程式为
(5)“沉钯”时反应的化学方程式为
(6)
 (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
2024-04-09更新
|
281次组卷
|
3卷引用:河南省濮阳市2024届高三下学期第二次模拟考试理科综合化学试题
解题方法
8 . 过渡元素因其独特的化学性质和物理特性,在现代工农业生产和科技发展方面发挥着重要作用。不仅在金属材料、合金材料、磁性材料、催化剂、医疗器材等多个传统领城有着广泛的用途,还在新材料的开发、能源的生产利用等方而展现出新的潜力。
(1)Fe元素在元素周期表中的位置为__________ ,Fe元素的原子结构示意图为__________ 。基态 的核外电子排布式为
的核外电子排布式为__________ 。
(2)基态Cr原子价层电子的轨道表示式为__________ 。
(3)基态Zn原子中有__________ 种不同能量的电子。
(4)配位化学创始人维尔纳发现,取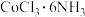 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出
(紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出 的化学式:
的化学式:__________ 。
(1)Fe元素在元素周期表中的位置为
 的核外电子排布式为
的核外电子排布式为(2)基态Cr原子价层电子的轨道表示式为
(3)基态Zn原子中有
(4)配位化学创始人维尔纳发现,取
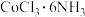 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出
(紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出 的化学式:
的化学式:
您最近一年使用:0次
2024-04-08更新
|
54次组卷
|
2卷引用:河南省南阳市六校联考2023-2024学年高二下学期3月月考化学试卷
9 . 钴是一种十分稀缺的金属,素有“工业味精”和“工业牙齿”之称。水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:

已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co子的价层电子排布式为___________ 。
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ 。(用离子方程式表示)
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
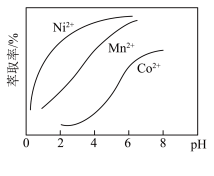
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为___________ 。
a. b.
b. 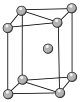 c.
c. 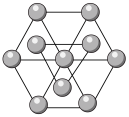
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于___________ ,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为___________ (用含π的代数式表示)。


已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co子的价层电子排布式为
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。

| A.1~2 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为
a.
 b.
b.  c.
c. 
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于

您最近一年使用:0次
名校
解题方法
10 . 我国科学家利用锰族催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇在S3Yz·态的可逆结构异构化如图。
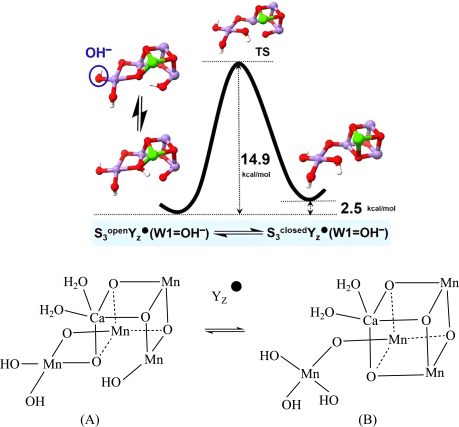
请回答下列问题:
(1)基态锰原子电子排布式为______ 。
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为______ (用元素符号表示),Mn元素位于元素周期表第______ 周期第______ 族。
(3)根据上图可知,稳定性:A______ B(填“>”“<”或“=”)。
(4)1molA含______ molH-Oσ键。
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是______ 。
②该晶胞中含有Ca2+的数目为______ ,距离O2-最近的Ca2+的数目有______ 个。
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为______ g/cm3.

请回答下列问题:
(1)基态锰原子电子排布式为
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为
(3)根据上图可知,稳定性:A
(4)1molA含
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是
②该晶胞中含有Ca2+的数目为
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为
您最近一年使用:0次
2024-03-29更新
|
259次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高三下学期3月月考化学试题



