钴是一种十分稀缺的金属,素有“工业味精”和“工业牙齿”之称。水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:

已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co子的价层电子排布式为___________ 。
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ 。(用离子方程式表示)
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
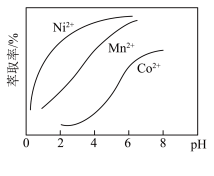
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为___________ 。
a. b.
b. 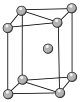 c.
c. 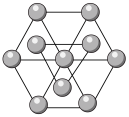
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于___________ ,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为___________ (用含π的代数式表示)。


已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co子的价层电子排布式为
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。

| A.1~2 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为
a.
 b.
b.  c.
c. 
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于

更新时间:2024-03-29 15:46:32
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:

i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 。
。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施______________________ (任填一条即可)。固体A的成分是__________ 。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为_________ ,目的是_________________________ 。
(3)写出④反应的离子方程式_________________________________________________________________ 。
(4)将溶液H经过________________________________ (操作)即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的 ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:

(5)第①步反应的离子方程式是_______________________________________________________________ 。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为______________ mol/L(已知:101/2≈3.2)。
(7)欲使 1L 该废水中的 完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为
完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________ g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。

i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为
 。
。ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
| 开始沉淀的PH | 2.7 | 3.4 | 5.5 | 7.5 | 0.7 |
| 沉淀完全的PH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为
(3)写出④反应的离子方程式
(4)将溶液H经过
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的
 ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
(5)第①步反应的离子方程式是
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为
(7)欲使 1L 该废水中的
 完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为
完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】硼氢化钠(NaBH4)具有强还原剂,可溶于异丙胺或水,强碱环境下能稳定存在。实验室制备、提纯及分析NaBH4的实验过程如下。
①NaH与B(OCH3)3反应的化学方程式为___________ 。
②下列说法正确的是___________ (填标号)。
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
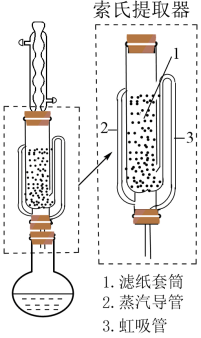
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。___________ (填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管___________ (填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后,NaBH4在___________ (填“圆底烧瓶”或“索氏提取器”)中。
②分离异丙胺和NaBH4并回收溶剂的方法是___________ 。
(3) 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入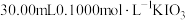 溶液充分反应
溶液充分反应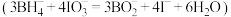 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗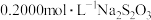 标准溶液
标准溶液 (发生反应
(发生反应 )。
)。
①根据所给试剂,判断 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为___________ 、___________ (填标号)。
A.稀硫酸
B. 溶液
溶液
C. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
D. 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)
②加入“溶液X2”后,发生的主要反应的离子方程式为___________ 。
③产品中 的纯度为
的纯度为___________  。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果___________ (填“偏高”或“偏低”)。

①NaH与B(OCH3)3反应的化学方程式为
②下列说法正确的是
A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高转化率
(2)NaBH4的提纯:采用索氏提取法提纯,其装置如图所示。
②分离异丙胺和NaBH4并回收溶剂的方法是
(3)
 的纯度分析:取
的纯度分析:取 产品(假设杂质不参与反应)溶于
产品(假设杂质不参与反应)溶于 溶液后配成200
溶液后配成200 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入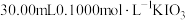 溶液充分反应
溶液充分反应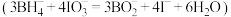 ;向上述溶液中加入过量的
;向上述溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,冷却后暗处放置数分䌺;继续加入缓冲溶液
,冷却后暗处放置数分䌺;继续加入缓冲溶液 调
调 约为5.0,以淀粉为指示剂,平均消耗
约为5.0,以淀粉为指示剂,平均消耗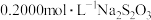 标准溶液
标准溶液 (发生反应
(发生反应 )。
)。①根据所给试剂,判断
 溶液和缓冲溶液
溶液和缓冲溶液 依次为
依次为A.稀硫酸
B.
 溶液
溶液C.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)D.
 和
和 混合液(溶质物质的量之比为1:1)
混合液(溶质物质的量之比为1:1)②加入“溶液X2”后,发生的主要反应的离子方程式为
③产品中
 的纯度为
的纯度为 。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】金属钛无毒、密度小而强度高,广泛用于航天材料、人造骨骼的制造等,有航天金属和生命金属的美誉。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:_______ ;B溶于氨水所得产物为:_______ ;
②A水解的化学反应方程式为:_______ ,理论计算可知,该反应的平衡常数很大,增加HCl浓度不足以抑制反应的进行,可是在浓盐酸中,A却几乎不水解,原因是:_______ ;
③C溶液与适量氯化铜溶液反应的化学方程式为:_______
(2)已知钛的元素电势图(E /V)为:
/V)为:
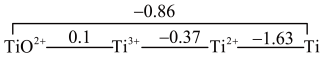
则:Ti2+_______ (填“能”或“不能”)在水溶液中稳定存在;Ti溶于热浓盐酸的化学反应方程式为_______ 。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:
②A水解的化学反应方程式为:
③C溶液与适量氯化铜溶液反应的化学方程式为:
(2)已知钛的元素电势图(E
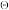 /V)为:
/V)为: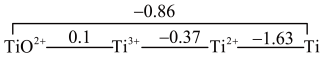
则:Ti2+
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】下表为元素周期表的一部分。请回答下列问题:
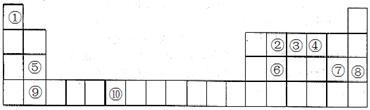
(1)上述元素中,属于s区的是___________ (填元素符号)。
(2)写出元素⑩的基态原子的电子排布式________________ 。
(3)元素第一电离能为⑤_______________ ⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有______________ 对弧对电子,其VSEPR模型为_____________ ;中心原子的杂化类型为_______________ ;该分子为_________________ 分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________________ 。
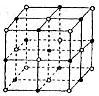
(5)元素⑦的钠盐晶胞结构如上图所示,每个Na+周围与之距离最近的Na+的个数为_____________ 。若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为________ (写出计算式)。

(1)上述元素中,属于s区的是
(2)写出元素⑩的基态原子的电子排布式
(3)元素第一电离能为⑤
(4)元素③气态氢化物的中心原子有

(5)元素⑦的钠盐晶胞结构如上图所示,每个Na+周围与之距离最近的Na+的个数为
您最近一年使用:0次
【推荐2】利用 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。
(1) 的价层电子排布式:
的价层电子排布式:_______ ,下图为 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是_______ 。

I.电解法制取
(2)利用铜和钛做电极,电解含有 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______ 。
II.利用 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。
(3)光照射到 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:_______ 。

(4)研究中对 的作用提出两种假设:
的作用提出两种假设:
a. 作光催化剂;
作光催化剂;
b. 与
与 发生氧化还原反应。
发生氧化还原反应。
已知: 的添加量是
的添加量是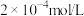 ,
, 的初始浓度是
的初始浓度是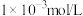 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______ ,依据是_______ 。

(5)溶液的 对
对 降解率的影响如图所示。
降解率的影响如图所示。

已知: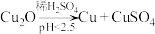 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。
① 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是_______ ,其原因是_______ 。
②已知 时,会产生
时,会产生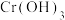 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是_______ 。
 光催化可以处理含有
光催化可以处理含有 的废水。
的废水。(1)
 的价层电子排布式:
的价层电子排布式: 的晶胞,其中●代表的元素是
的晶胞,其中●代表的元素是
I.电解法制取

(2)利用铜和钛做电极,电解含有
 和
和 的溶液时,
的溶液时, 浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是II.利用
 光催化处理含
光催化处理含 的废水的研究。
的废水的研究。(3)光照射到
 光催化剂上产生光催化反应,
光催化剂上产生光催化反应, 和光照
和光照 分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出
分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出 转化
转化 的电极反应:
的电极反应:
(4)研究中对
 的作用提出两种假设:
的作用提出两种假设:a.
 作光催化剂;
作光催化剂;b.
 与
与 发生氧化还原反应。
发生氧化还原反应。已知:
 的添加量是
的添加量是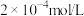 ,
, 的初始浓度是
的初始浓度是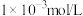 ,对比实验(
,对比实验( 且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是
(5)溶液的
 对
对 降解率的影响如图所示。
降解率的影响如图所示。
已知:
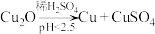 ;酸性越大,
;酸性越大, 被还原率越大。
被还原率越大。①
 分别为2、3、4时,
分别为2、3、4时, 的降解率最好的是
的降解率最好的是②已知
 时,会产生
时,会产生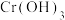 沉淀,则
沉淀,则 时,
时, 的降解率低的原因是
的降解率低的原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。请回答下列问题:
(1)基态Fe3+的电子排布式可表示为__________________ 。
(2)与CN-互为等电子体的分子有___________ (写出2种)。
(3)金属配合物Fe(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=_____ 。
Ⅱ.已知氮化铝的晶胞结构如图所示。请回答下列问题:
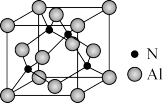
(4)下列说法正确的是__________ (填序号)。
(5)NH3空间构型为______ ;已知(CH3)3Al为非极性分子,则其中铝原子的杂化方式为__________ 。
(6)若氮化铝可由(CH3)3Al和NH3在一定条件下反应制得,则反应的方程式为_________ 。
(7)若Al与N 原子最近的距离为a cm,则该晶体的密度为____ g/cm。(阿伏加德罗常数用NA表示)
(1)基态Fe3+的电子排布式可表示为
(2)与CN-互为等电子体的分子有
(3)金属配合物Fe(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
Ⅱ.已知氮化铝的晶胞结构如图所示。请回答下列问题:

(4)下列说法正确的是
| A.氮化铝晶胞结构与NaCl相同 | B.第一电离能 N>Al |
| C.电负性N>Al | D.原子半径 N>Al |
(6)若氮化铝可由(CH3)3Al和NH3在一定条件下反应制得,则反应的方程式为
(7)若Al与N 原子最近的距离为a cm,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
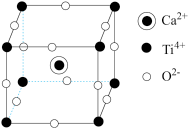
【推荐1】(Ⅰ)如图所示为高温超导领域里的一种化合物——钙钛矿晶胞结构,该结构是具有代表性的最小重复单位。

(1)该晶胞结构中,元素氧、钛、钙的离子个数比是___________ ,该物质的化学式可表示为___________ 。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶胞结构图中正方体边长(钛原子之间的距离)为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的密度为
,则该晶胞的密度为___________  。
。
(Ⅱ)氮化碳的结构如下图所示:已知氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。

(3)氮化硅的硬度___________ (填“大于”或“小于”)氮化碳的硬度,原因是___________ ;
(4)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:___________ 。
(5)第ⅢA、ⅤA族元素组成的化合物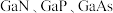 等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在
等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在 晶体中与同一个
晶体中与同一个 原子相连的N原子构成的空间构型为
原子相连的N原子构成的空间构型为___________ , 属于
属于___________ 晶体。

(1)该晶胞结构中,元素氧、钛、钙的离子个数比是
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶胞结构图中正方体边长(钛原子之间的距离)为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的密度为
,则该晶胞的密度为 。
。(Ⅱ)氮化碳的结构如下图所示:已知氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。

(3)氮化硅的硬度
(4)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:
(5)第ⅢA、ⅤA族元素组成的化合物
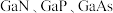 等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在
等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在 晶体中与同一个
晶体中与同一个 原子相连的N原子构成的空间构型为
原子相连的N原子构成的空间构型为 属于
属于
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】南京工业大学某研究团队最近在《Nature Communications》刊文介绍了他们开发的一种新型催化剂——反钙钛矿基非贵金属催化剂,这种价廉的新型催化剂结合了钙钛矿结构的灵活性和过渡金属氮(碳)化合物的高导电性、优异电催化性等优点,理论上来说是一种很有发展潜力的析氧反应电催化剂。回答下列问题:
(1)基态氮原子核外未成对电子数为________ ,基态碳原子核外电子云有_______ 个伸展方向。
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是_________ ,中心原子的杂化类型是________ 。
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为__ 。
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为_____________ ;1个钛离子与________ 个氧离子等距离且最近,这些氧离子可构成正八面体,钛离子位于该正八面体的体心。已知钛酸钙的晶胞参数为a nm,则该正八面体的边长为________ pm。
(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加 德罗常数的值,则晶胞的密度为________________ g·cm-3(列出计算式即可)。

(1)基态氮原子核外未成对电子数为
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为

(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加 德罗常数的值,则晶胞的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】【化学一选修3:物质结构与性质】铜及其化合物在化工生产中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置为_________________ ,基态Cu原子核外电子占据的原子轨道数为____________________ 。
(2)向硫酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH3)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。
①乙二胺分子中C、N原子的杂化轨道类型分别为_______________ 、_________________ 。
②与硫酸根离子互为等电子体的分子为___________ (任写一种)。
③四配位离子的结构式为_____________________ ,该离子中所有元素的电负性由大到小的顺序为____________________________ 。
(3)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为___________ (填化学式),原因为________________________________________________ 。
(4)下图为铜与氧(O)、钇(Y)、钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。

①该超导体材料的化学式为____________________________ 。
②已知该化合物的摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,其密度为____ g·cm-3(列出表达式即可)。
(1)铜元素在元素周期表中的位置为
(2)向硫酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH3)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。
①乙二胺分子中C、N原子的杂化轨道类型分别为
②与硫酸根离子互为等电子体的分子为
③四配位离子的结构式为
(3)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为
(4)下图为铜与氧(O)、钇(Y)、钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。

①该超导体材料的化学式为
②已知该化合物的摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,其密度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】镉(Cd)可用于制作某些发光电子组件。一种用铜镉废渣(含Cd、Zn、Cu、Fe等单质)为原料制备镉的工艺流程如图。
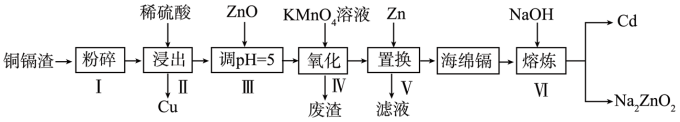
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算):
回答下列问题:
(1)“步骤II”需隔绝氧气进行的原因是_______ 。“步骤III”使用ZnO调节pH至5,还可以使用_______ (填化学式)代替ZnO达到目的。
(2)“氧化”时,KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式为_______ ,该步骤得到的滤渣成分为_______ (填化学式)。
(3)“置换”时,镉置换率与 的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
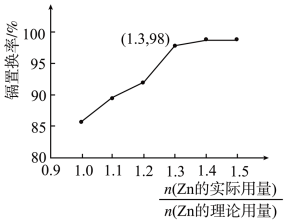
①实际生产中 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是_______ 。
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为_______ kg(计算结果保留一位小数)。
(4)“置换”后,滤液溶质主要成分有_______ (填化学式)。
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH固体在反应釜中混合反应,该反应的化学方程式为_______ 。当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)“步骤II”需隔绝氧气进行的原因是
(2)“氧化”时,KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式为
(3)“置换”时,镉置换率与
 的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
①实际生产中
 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为
(4)“置换”后,滤液溶质主要成分有
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH固体在反应釜中混合反应,该反应的化学方程式为
您最近一年使用:0次
【推荐2】某工厂产生的废渣中主要含有ZnO,另含有少量FeO、CuO、SiO2等,某科研人员设计的用废渣制取高纯ZnO的工艺流程图如下图所示。

已知:25℃时,部分物质的Ksp相关信息如表所示:
(1)“酸浸”步骤中发生的离子反应有___________ 个。
(2)“氧化”时发生反应的离子方程式为___________ 。
(3)“除铁”时除了加ZnO,还可以加入___________ (填化学式)
(4)若“氧化”后所得滤液中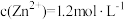 ,
,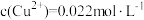 ,“除铁”操作中为了使铁元素完全除去(
,“除铁”操作中为了使铁元素完全除去(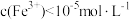 除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是
除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是___________ ,滤渣B为___________ 。
(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”………也可以除去 和
和 ,并回收CuS和
,并回收CuS和 ,该设计是否合理
,该设计是否合理___________ (填“是”或“否”),理由是___________ 。
(6)称量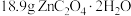 晶体隔绝空气加热分解,剩余固体质量随温度的变化曲线如图所示,加热温度为200℃~400℃范围内,生成两种碳的氧化物,则M→N的化学方程式为:
晶体隔绝空气加热分解,剩余固体质量随温度的变化曲线如图所示,加热温度为200℃~400℃范围内,生成两种碳的氧化物,则M→N的化学方程式为:___________ 。


已知:25℃时,部分物质的Ksp相关信息如表所示:
 |  |  |  | CuS | ZnS |
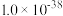 | 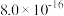 | 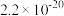 | 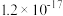 | 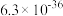 | 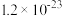 |
(1)“酸浸”步骤中发生的离子反应有
(2)“氧化”时发生反应的离子方程式为
(3)“除铁”时除了加ZnO,还可以加入
(4)若“氧化”后所得滤液中
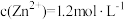 ,
,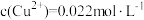 ,“除铁”操作中为了使铁元素完全除去(
,“除铁”操作中为了使铁元素完全除去(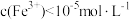 除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是
除去完全),又不影响高纯ZnO的产量,可以调节pH的范围是(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”………也可以除去
 和
和 ,并回收CuS和
,并回收CuS和 ,该设计是否合理
,该设计是否合理(6)称量
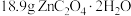 晶体隔绝空气加热分解,剩余固体质量随温度的变化曲线如图所示,加热温度为200℃~400℃范围内,生成两种碳的氧化物,则M→N的化学方程式为:
晶体隔绝空气加热分解,剩余固体质量随温度的变化曲线如图所示,加热温度为200℃~400℃范围内,生成两种碳的氧化物,则M→N的化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】二氯化二硫 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)选用以下装置制取少量 (加热及夹持装置略)。
(加热及夹持装置略)。

①写出A中发生反应的化学方程式_______ 。
②装置连接顺序:A→_______ 。
③B中玻璃纤维的作用是什么_______ ?
④D中盛放的试剂是什么_______ ?
(2) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。

①W溶液可以是下列溶液中的_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液
②计算混合气体中 的体积分数
的体积分数______ (用含 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)选用以下装置制取少量
 (加热及夹持装置略)。
(加热及夹持装置略)。
①写出A中发生反应的化学方程式
②装置连接顺序:A→
③B中玻璃纤维的作用是什么
④D中盛放的试剂是什么
(2)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
①W溶液可以是下列溶液中的
a.
 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液②计算混合气体中
 的体积分数
的体积分数 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
您最近一年使用:0次



