名校
1 . 镍是一种常用催化剂。某工厂采用以下流程提取含镍废料(主要含Ni、NiO,以及少量CuO、FeO、 、MgO、ZnO、
、MgO、ZnO、 和
和 等)中的镍,实现资源再利用。
等)中的镍,实现资源再利用。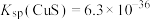 和
和
常温下,某些金属离子形成氢氧化物开始沉淀和完全沉淀的pH:
回答下列问题:
(1)NiO中 的核外电子排布式为
的核外电子排布式为___________ 。
(2)为提高酸浸率,可采取的措施有___________ (写出两项即可)。
(3)当 、
、 完全沉淀时,溶液中
完全沉淀时,溶液中 浓度至少应为
浓度至少应为___________ (常温下,当溶液中的离子浓度小于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(4)沉淀池2中加入 的目的是
的目的是___________ (用离子方程式表示),为使相应离子完全沉淀,沉淀池2的pH范围应控制在___________ 。
(5)沉淀3的成分是___________ (填化学式)。
(6)用滴定法测定 产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的
产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为12.40mL。(已知:ⅰ.
标准液平均值为12.40mL。(已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。)
显橙黄色。)
①滴定至终点的现象是___________ 。
②样品中镍元素的质量分数为___________ (保留4位有效数字)。
 、MgO、ZnO、
、MgO、ZnO、 和
和 等)中的镍,实现资源再利用。
等)中的镍,实现资源再利用。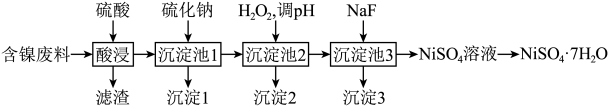
 和
和
常温下,某些金属离子形成氢氧化物开始沉淀和完全沉淀的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 8.6 | 7.1 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 11.1 | 9.0 |
(1)NiO中
 的核外电子排布式为
的核外电子排布式为(2)为提高酸浸率,可采取的措施有
(3)当
 、
、 完全沉淀时,溶液中
完全沉淀时,溶液中 浓度至少应为
浓度至少应为 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(4)沉淀池2中加入
 的目的是
的目的是(5)沉淀3的成分是
(6)用滴定法测定
 产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的
产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为12.40mL。(已知:ⅰ.
标准液平均值为12.40mL。(已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。)
显橙黄色。)①滴定至终点的现象是
②样品中镍元素的质量分数为
您最近一年使用:0次
解题方法
2 . 氯化铵焙烧菱锰矿 (主要成分为  , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
②常温下, 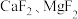 的溶度积分别为
的溶度积分别为 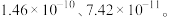
回答下列问题:
(1)基态锰原子的电子排布式为______ ,  的空间结构为
的空间结构为_______ 。
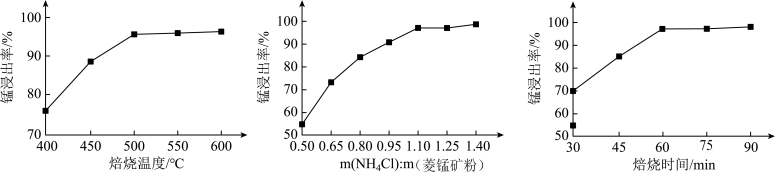
(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是_______ 。
(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的_______ (填化学式)。
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为_______ ; 若溶液中金属离子浓度均为0.1 mol·L-1,调节溶液pH使 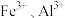 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为_______ ,再加入NH4F 沉淀Ca²⁺、Mg²⁺,_______ ,当 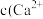 +
+  时,
时,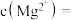
_______ 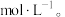
(5)碳化结晶时,发生反应的离子方程式为_______ 。
(6)流程中能循环利用的固态物质是_______ (填化学式)。
 , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下: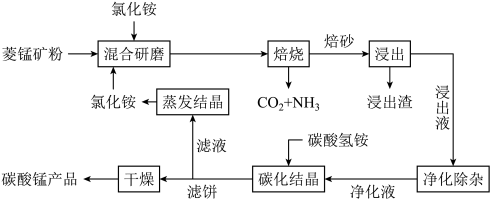
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的 pH | 3.8 | 1.5 | 6.5 | 10.6 | 8.1 | 9.6 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 12.6 | 10.1 | 11.6 |
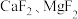 的溶度积分别为
的溶度积分别为 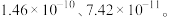
回答下列问题:
(1)基态锰原子的电子排布式为
 的空间结构为
的空间结构为(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是

(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为
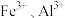 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为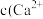 +
+  时,
时,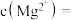
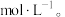
(5)碳化结晶时,发生反应的离子方程式为
(6)流程中能循环利用的固态物质是
您最近一年使用:0次
名校
3 . 化合物 是一种化学药物合成的重要中间体。
是一种化学药物合成的重要中间体。 的一种合成路线如图所示。
的一种合成路线如图所示。
(1)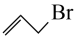 中基态
中基态 原子的核外电子排布式为
原子的核外电子排布式为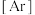
_______ 。
(2)有机物 的结构简式为
的结构简式为_______ , 的反应类型为
的反应类型为_______ 。
(3) 的化学方程式为
的化学方程式为_______ 。
(4)有机物 是
是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 有
有_______ 种(不考虑立体异构);
①分子中除苯环外不含其他环状结构
②仅含有一种官能团,能与新制 反应生成砖红色沉淀
反应生成砖红色沉淀
③苯环上有3个取代基
其中核磁共振氢谱显示为5组峰,且峰面积之比为 的同分异构体的结构简式为
的同分异构体的结构简式为_______ (写出一种即可)。
(5)设计以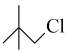 和
和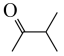 为原料制备
为原料制备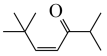 的合成路线:
的合成路线:_______ 。
 是一种化学药物合成的重要中间体。
是一种化学药物合成的重要中间体。 的一种合成路线如图所示。
的一种合成路线如图所示。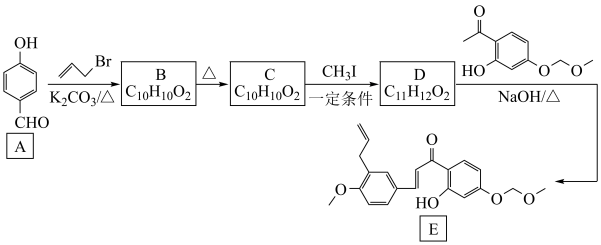
已知:Ⅰ.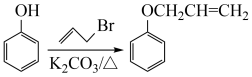

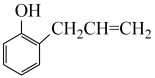 。
。
Ⅱ.R1-CHO+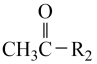

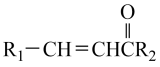 。
。
(1)
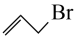 中基态
中基态 原子的核外电子排布式为
原子的核外电子排布式为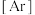
(2)有机物
 的结构简式为
的结构简式为 的反应类型为
的反应类型为(3)
 的化学方程式为
的化学方程式为(4)有机物
 是
是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 有
有①分子中除苯环外不含其他环状结构
②仅含有一种官能团,能与新制
 反应生成砖红色沉淀
反应生成砖红色沉淀③苯环上有3个取代基
其中核磁共振氢谱显示为5组峰,且峰面积之比为
 的同分异构体的结构简式为
的同分异构体的结构简式为(5)设计以
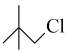 和
和 为原料制备
为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
名校
4 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量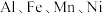 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位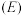 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应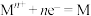 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: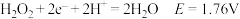 ;
;
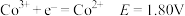
碱性条件: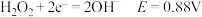 ;
;
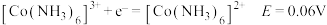
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将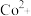 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则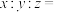
______ 。
 (含炭黑及少量
(含炭黑及少量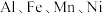 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
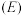 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应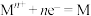 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
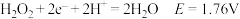 ;
;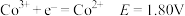
碱性条件:
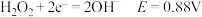 ;
;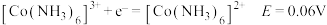
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。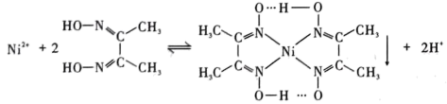
 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
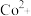 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料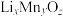 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则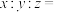

您最近一年使用:0次
2024-05-16更新
|
162次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题
名校
5 . 物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。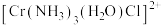 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)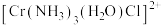 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和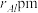 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
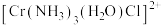 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
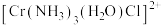 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和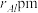 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次
解题方法
6 . 工业上用软锰矿(主要含 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。_______ 个未成对电子,Mn元素位于元素周期表的______ 区。
(2)提高“酸浸”浸出率可采取的措施有______ (写两条),“冰水沉积”的目的是____________ 。
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是______ (填化学式)。
(4)“酸浸”时,PbS与 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式____________ 。
(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是____________ 。
(6)“氧化”时,发生的主要反应的离子方程式为____________ 。
(7)通过 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式______________ 。
 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。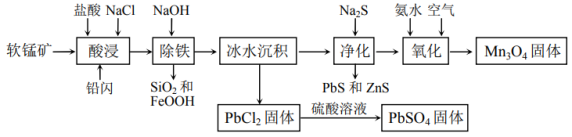
(2)提高“酸浸”浸出率可采取的措施有
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是
(4)“酸浸”时,PbS与
 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是
(6)“氧化”时,发生的主要反应的离子方程式为
(7)通过
 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式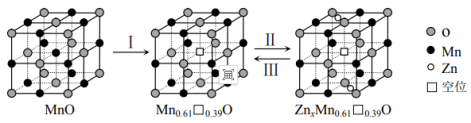
您最近一年使用:0次
2024-04-15更新
|
215次组卷
|
2卷引用:重庆市2024届高三普通高中学业水平选择性考试第二次联合诊断检测化学试题
名校
解题方法
7 . 用红土镍矿(含 、
、 、
、 、
、 等元素的氧化物)制取一种镍的氧化物的工艺流程如图所示,制得的该氧化物的晶胞结构为:镍离子位于顶点和面心,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。下列说法错误的是
等元素的氧化物)制取一种镍的氧化物的工艺流程如图所示,制得的该氧化物的晶胞结构为:镍离子位于顶点和面心,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。下列说法错误的是
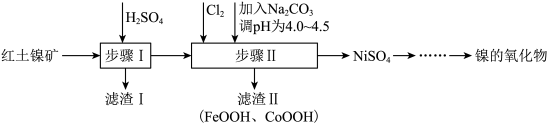
 、
、 、
、 、
、 等元素的氧化物)制取一种镍的氧化物的工艺流程如图所示,制得的该氧化物的晶胞结构为:镍离子位于顶点和面心,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。下列说法错误的是
等元素的氧化物)制取一种镍的氧化物的工艺流程如图所示,制得的该氧化物的晶胞结构为:镍离子位于顶点和面心,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。下列说法错误的是
A.滤渣I的主要成分为 |
B.步骤Ⅱ除铁的离子方程式为 |
C.该氧化物中镍离子的价层电子排布式为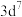 |
D.从该氧化物晶胞中能分割出来的结构图有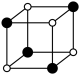 和 和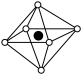 |
您最近一年使用:0次
名校
解题方法
8 . 砷为第四周期ⅤA族元素,金属冶炼过程产生的含砷废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
(1)①亚砷酸中砷元素的化合价为_____ 。
②基态砷原子的最外层电子排布式为______ 。
③砷酸(H3AsO4)的第一步电离方程式为_______ 。
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式_____ 。
(3)沉淀X主要为一种盐_______ (填化学式)。
(4)根据流程推测:亚砷酸盐的溶解性_____ (填“大于”或“小于”)相应砷酸盐。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为________ 。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量_______ (填“符合”或“不符合”)排放标准。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

(1)①亚砷酸中砷元素的化合价为
②基态砷原子的最外层电子排布式为
③砷酸(H3AsO4)的第一步电离方程式为
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式
(3)沉淀X主要为一种盐
(4)根据流程推测:亚砷酸盐的溶解性
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量
您最近一年使用:0次
名校
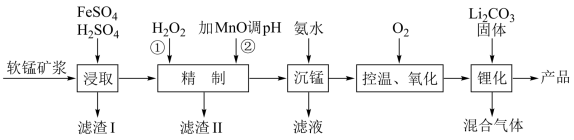
9 . 锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂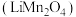 ,工业流程如下图所示:
,工业流程如下图所示:
(1)基态 原子的价电子排布式为
原子的价电子排布式为______ 。
(2)“精制”过程中,实际加入 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是______ ; 是含有
是含有______ 键(填“极性”或“非极性”,下同)和______ 键的______ 分子: 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释______ 。
(3)“沉锰”过程得到的是 和
和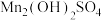 ,二者均可以被氧化为
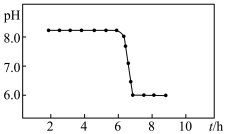
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是______ (用化学方程式表示)。
(4)“锂化”过程是将 和
和 按
按 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是______ 。
 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂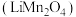 ,工业流程如下图所示:
,工业流程如下图所示:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“精制”过程中,实际加入
 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是 是含有
是含有 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释(3)“沉锰”过程得到的是
 和
和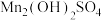 ,二者均可以被氧化为
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是
(4)“锂化”过程是将
 和
和 按
按 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
您最近一年使用:0次
解题方法
10 . 铝酸铋[Bi(AlO2)3]主要用作抗酸药及抗溃疡药,具有中和胃酸和收敛作用。以辉铋矿(主要成分为 Bi2S3,含有: 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:

已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于___________ 区,铋的价层电子排布式为___________ 。
(2)“浸取”过程中,提高浸出率的措施有___________ 。(写一条即可)
(3)滤渣1的主要成分为S和___________ ,“浸取”步骤中生成S的主要离子反应为___________ 。
(4)“还原”时, 加入铋的目的是___________ 。
(5)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为______ 。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
(6)在碱性溶液中,可用 鉴定Bi3+存在,Bi3+被还原为Bi,
鉴定Bi3+存在,Bi3+被还原为Bi, 自身变为[Sn(OH)6]2⁻,该反应的离子方程式为
自身变为[Sn(OH)6]2⁻,该反应的离子方程式为______ 。
 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于
(2)“浸取”过程中,提高浸出率的措施有
(3)滤渣1的主要成分为S和
(4)“还原”时, 加入铋的目的是
(5)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
(6)在碱性溶液中,可用
 鉴定Bi3+存在,Bi3+被还原为Bi,
鉴定Bi3+存在,Bi3+被还原为Bi, 自身变为[Sn(OH)6]2⁻,该反应的离子方程式为
自身变为[Sn(OH)6]2⁻,该反应的离子方程式为
您最近一年使用:0次







