名校
解题方法
1 . 钼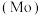 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)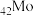 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4) 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6)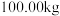 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为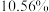 )通过该工艺最终得到
)通过该工艺最终得到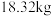 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=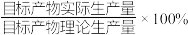 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。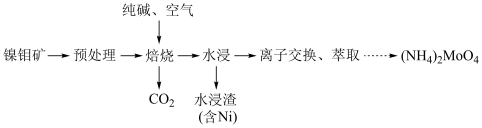
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
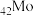 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: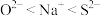 |
C.第一电离能: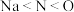 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
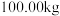 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为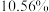 )通过该工艺最终得到
)通过该工艺最终得到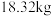 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=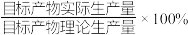 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为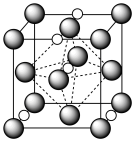
您最近一年使用:0次
7日内更新
|
165次组卷
|
3卷引用:江西部分高中2024届高三下学期5月大联考化学试卷
名校
2 . 锑属于氮族元素,广泛用于制造合金、瓷器、颜料、印刷油墨、防爆材料等。现用锑精矿(主要含有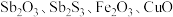 等杂质)来制备锑和焦锑酸钠
等杂质)来制备锑和焦锑酸钠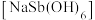 。其工艺流程如图所示:
。其工艺流程如图所示: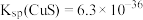 ,
,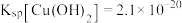 。
。
回答下列问题:
(1) 位于元素周期表的
位于元素周期表的___________ 区,其基态原子的价电子排布式为___________ 。
(2)滤渣Ⅰ的主要成分有___________ 。
(3)“碱浸”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(4)“电解”过程中,阳极上发生的两个电极反应式为___________ 、___________ 。
(5)滤渣Ⅱ的主要成分有___________ 。
(6)产品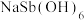 需洗涤、干燥,检验固体是否洗涤干净的试剂为
需洗涤、干燥,检验固体是否洗涤干净的试剂为___________ (填化学式)。
(7)常温条件下,向碱浸液中加入 溶液,生成
溶液,生成 和
和 沉淀时,溶液的
沉淀时,溶液的 为10,则溶液中剩余
为10,则溶液中剩余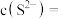
___________  。
。
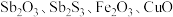 等杂质)来制备锑和焦锑酸钠
等杂质)来制备锑和焦锑酸钠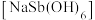 。其工艺流程如图所示:
。其工艺流程如图所示: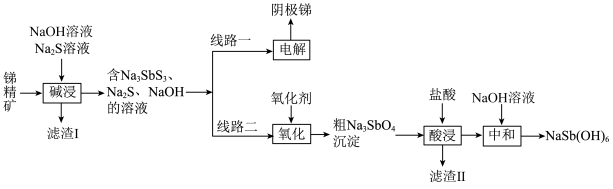
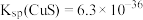 ,
,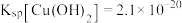 。
。回答下列问题:
(1)
 位于元素周期表的
位于元素周期表的(2)滤渣Ⅰ的主要成分有
(3)“碱浸”时,
 发生反应的化学方程式为
发生反应的化学方程式为(4)“电解”过程中,阳极上发生的两个电极反应式为
(5)滤渣Ⅱ的主要成分有
(6)产品
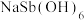 需洗涤、干燥,检验固体是否洗涤干净的试剂为
需洗涤、干燥,检验固体是否洗涤干净的试剂为(7)常温条件下,向碱浸液中加入
 溶液,生成
溶液,生成 和
和 沉淀时,溶液的
沉淀时,溶液的 为10,则溶液中剩余
为10,则溶液中剩余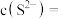
 。
。
您最近一年使用:0次
3 . 硫化锶(SrS)可用作发光材料、光谱纯试剂和燃料添加剂。工业上可用碳热还原法制备SrS,相关反应及信息如下表所示:
回答下列问题:
(1)Sr与Ca同族且相邻。基态Sr原子的电子排布式为___________ 。
(2)反应Ⅰ、Ⅱ、Ⅲ中,自发进行所需温度最高的是___________ (填反应序号)。
(3)将1 mol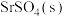 和3 mol
和3 mol 加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示: ℃时容器内几乎不发生反应Ⅲ的原因为
℃时容器内几乎不发生反应Ⅲ的原因为___________ 。
②若 ℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
___________ (用含t的代数式表示)。
③温度高于 ℃时,容器内发生主要反应的热化学方程式为
℃时,容器内发生主要反应的热化学方程式为___________ 。
④ ℃时,反应Ⅰ的平衡常数
℃时,反应Ⅰ的平衡常数
___________ ( 是用平衡浓度表示的平衡常数)。
是用平衡浓度表示的平衡常数)。
⑤M、N点对应状态下继续反应一段时间,其平均反应速率 :M
:M___________ N(填“>”“<”或“=”),理由为___________ 。
(4)若起始以物质的量之比为1∶1向密闭容器中加入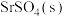 和
和 发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高
发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高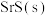 平衡产量的是
平衡产量的是___________ (填选项字母)。
A.适当升高温度 B.适当增大压强 C.使用更高效的催化剂
| 反应 | 焓变 /kJ·mol /kJ·mol | 熵变 /kJ·mol /kJ·mol ·K ·K |
Ⅰ. | +189.1 | 0.37 |
Ⅱ. | +534.0 | 0.72 |
Ⅲ.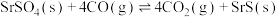 | -155.8 | 0.015 |
(1)Sr与Ca同族且相邻。基态Sr原子的电子排布式为
(2)反应Ⅰ、Ⅱ、Ⅲ中,自发进行所需温度最高的是
(3)将1 mol
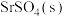 和3 mol
和3 mol 加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
 ℃时容器内几乎不发生反应Ⅲ的原因为
℃时容器内几乎不发生反应Ⅲ的原因为②若
 ℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
③温度高于
 ℃时,容器内发生主要反应的热化学方程式为
℃时,容器内发生主要反应的热化学方程式为④
 ℃时,反应Ⅰ的平衡常数
℃时,反应Ⅰ的平衡常数
 是用平衡浓度表示的平衡常数)。
是用平衡浓度表示的平衡常数)。⑤M、N点对应状态下继续反应一段时间,其平均反应速率
 :M
:M(4)若起始以物质的量之比为1∶1向密闭容器中加入
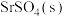 和
和 发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高
发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高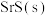 平衡产量的是
平衡产量的是A.适当升高温度 B.适当增大压强 C.使用更高效的催化剂
您最近一年使用:0次
4 . 一种从火法炼铜烟道灰(主要成分是 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和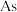 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(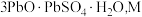 为
为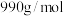 )的工艺如图:
)的工艺如图:
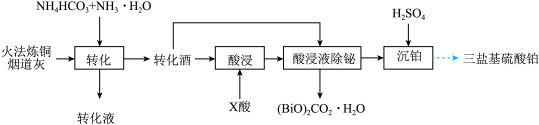
已知: 微溶于水
微溶于水
(1)写出铅原子的核外电子排布式:
_______ ,它位于元素周期表的_______ 区。
(2)转化过程温度选择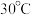 ,原因是
,原因是_______ 。
(3)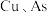 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为_______ 、_______ (填离子符号)。
(4)转化渣主要成分为碳酸铅和碳酸氧铋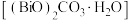 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:_______ 。
(5)加入适量的 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。
(6)转化渣除铋的离子方程式为_______ 。
(7)若使用 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为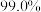 的三盐基硫酸铅
的三盐基硫酸铅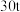 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为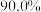 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为_______ 。
 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和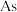 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(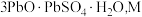 为
为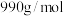 )的工艺如图:
)的工艺如图:
已知:
 微溶于水
微溶于水(1)写出铅原子的核外电子排布式:

(2)转化过程温度选择
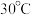 ,原因是
,原因是(3)
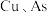 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为(4)转化渣主要成分为碳酸铅和碳酸氧铋
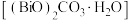 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:(5)加入适量的
 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。| A.盐酸 | B.硫酸 | C.硝酸 | D.氢硫酸 |
(6)转化渣除铋的离子方程式为
(7)若使用
 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为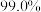 的三盐基硫酸铅
的三盐基硫酸铅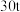 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为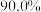 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 过渡金属元素铬( )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)请写出基态铬( )原子价电子的轨道表示式
)原子价电子的轨道表示式___________ 。
(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为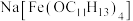 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:___________ 。
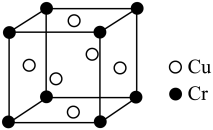
(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为___________ ;离 原子最近的
原子最近的 原子数目为
原子数目为___________ ,离 原子最近的
原子最近的 原子数目为
原子数目为___________ 。若该晶胞参数为apm,则该晶体的密度为___________ 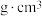 。
。___________ 种。其同主族元素Si可形成硅酸盐,下图中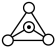 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为___________ 。
 )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)请写出基态铬(
 )原子价电子的轨道表示式
)原子价电子的轨道表示式(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为
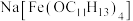 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为
 原子最近的
原子最近的 原子数目为
原子数目为 原子最近的
原子最近的 原子数目为
原子数目为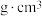 。
。
 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为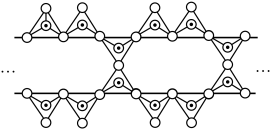
您最近一年使用:0次
名校
解题方法
6 . 下列化学用语表示错误的是
| A.基态镓原子的电子排布式为[Ar]4s24p1 |
B.60gSiO2中含有Si-O键数目为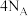 |
C.砷化氢(AsH3)分子的球棍模型: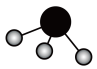 |
D.过氧化钠(Na2O2)的电子式: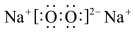 |
您最近一年使用:0次
名校
7 . 氮、磷、硫、氯元素在科研与生产中有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s轨道上的电子激发进入3d轨道而参与成键,则该激发态原子的核外电子排布式为_______ 。
(2)比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”)
离子(填“>”“<”或“=”)
(3)联氨( )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:_______ 。
(4)已知一定条件下发生反应: ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为_______ 。
(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为 ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(6) 中阴离子为
中阴离子为 ,
, 与
与 分子空间结构相似,由此可以推知
分子空间结构相似,由此可以推知 的空间结构为
的空间结构为_______ 。
(7) 尿素分子
尿素分子 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ ;电子式:碳化钙( )
)_______ 。
(8)三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为_______ 。

(1)磷原子在成键时,能将一个3s轨道上的电子激发进入3d轨道而参与成键,则该激发态原子的核外电子排布式为
(2)比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”)
离子(填“>”“<”或“=”)(3)联氨(
 )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:(4)已知一定条件下发生反应:
 ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为
 ,则
,则 中的大π键应表示为
中的大π键应表示为(6)
 中阴离子为
中阴离子为 ,
, 与
与 分子空间结构相似,由此可以推知
分子空间结构相似,由此可以推知 的空间结构为
的空间结构为(7)
 尿素分子
尿素分子 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为 )
)(8)三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为

您最近一年使用:0次
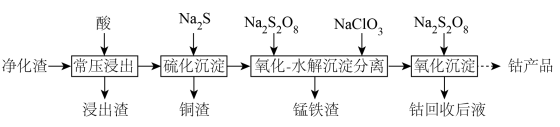
8 . 我国的钴(Co)资源非常贫乏,一种利用湿法炼锌净化渣回收钴的工艺如下图所示。已知净化渣含有较高的锌、铜、铅、钴元素以及一定量的铁和锰元素,它们大多以金属单质和氧化物的形式存在。
已知:①298K, ,
, ,
, 。
。
② 在酸性溶液中有强氧化性
在酸性溶液中有强氧化性
(1)写出钴原子的价层电子排布式:
(2)“常压浸出”需加热至70℃左右,宜采用
(3)大多数金属硫化物都难溶于水,能选择
 除铜的原因是
除铜的原因是 后溶液中
后溶液中 ,
, ,则溶液的pH约为
,则溶液的pH约为(4)过二硫酸钠(
 )氧化Mn2+生成MnO2沉淀,同时生成
)氧化Mn2+生成MnO2沉淀,同时生成 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:(5)根据流程可知:在“沉淀分离”步骤中,还原性Co2+
您最近一年使用:0次
2024-03-24更新
|
245次组卷
|
2卷引用:江西省南昌市2024届高三第一次模拟测试化学试卷
名校
9 . 氢叠氮酸( )属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出
)属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出 和
和 。分子结构示意图如图所示。回答下列问题:
。分子结构示意图如图所示。回答下列问题:

(1)下列有关说法正确的是___________(填字母符号)。
(2)叠氮酸根可作为一种配体,在 中钴显
中钴显___________ 价,基态钴原子的价电子排布式为___________ 。 空间形状为
空间形状为___________ 。
(3) 与
与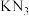 结构类似,前者熔点比后者
结构类似,前者熔点比后者___________ (填“大”或“小”), 中氮原子的第一电离能比氧原子
中氮原子的第一电离能比氧原子___________ (填“大”或“小”)。
(4)人造立方氮化硼是超硬材料,其晶胞如图所示。

①晶体中硼原子的配位数为___________ 。
②设该晶体的摩尔质量为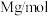 ,晶体的密度为ρ
,晶体的密度为ρ ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中的距离最近的硼原子之间的距离为
,则晶体中的距离最近的硼原子之间的距离为___________ cm。
 )属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出
)属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出 和
和 。分子结构示意图如图所示。回答下列问题:
。分子结构示意图如图所示。回答下列问题:
(1)下列有关说法正确的是___________(填字母符号)。
A. 中含有5个 中含有5个 键 键 | B. 中三个氮原子采用的都是sp2杂化 中三个氮原子采用的都是sp2杂化 |
C. 、 、 都是极性分子 都是极性分子 | D. 、 、 、 、 分子间都可以形成氢键 分子间都可以形成氢键 |
 中钴显
中钴显 空间形状为
空间形状为(3)
 与
与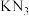 结构类似,前者熔点比后者
结构类似,前者熔点比后者 中氮原子的第一电离能比氧原子
中氮原子的第一电离能比氧原子(4)人造立方氮化硼是超硬材料,其晶胞如图所示。

①晶体中硼原子的配位数为
②设该晶体的摩尔质量为
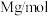 ,晶体的密度为ρ
,晶体的密度为ρ ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中的距离最近的硼原子之间的距离为
,则晶体中的距离最近的硼原子之间的距离为
您最近一年使用:0次
10 . 我国科学家用粗氢氧化高钴 制备硫酸钴晶体(
制备硫酸钴晶体(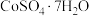 ),其工艺流程如下:
),其工艺流程如下:

已知:ⅰ.还原浸出液中的阳离子有: 、
、 、
、 和
和 等
等
ⅱ.部分物质的溶度积常数(25℃)
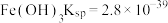
ⅲ.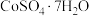 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大
(1)Co元素位于元素周期表的_______ 区,基态Co原子的核外电子排布式为_______ 。
(2)浸出 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为_______ 。
(3)写出“氧化沉铁”的离子方程式_______ ,25℃时,浊液中铁离子浓度为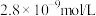 ,此时溶液
,此时溶液
_______ 。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为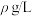 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗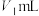 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。
计算样品中钴含量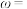
_______ (以钴的质量分数 计)。
计)。
(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高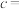
_______  (列出计算式)。
(列出计算式)。

 制备硫酸钴晶体(
制备硫酸钴晶体(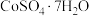 ),其工艺流程如下:
),其工艺流程如下:
已知:ⅰ.还原浸出液中的阳离子有:
 、
、 、
、 和
和 等
等ⅱ.部分物质的溶度积常数(25℃)

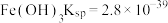
ⅲ.
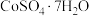 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大(1)Co元素位于元素周期表的
(2)浸出
 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为(3)写出“氧化沉铁”的离子方程式
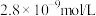 ,此时溶液
,此时溶液
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为
 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为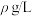 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗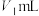 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。计算样品中钴含量
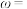
 计)。
计)。(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高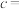
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



