解题方法
1 . 铬用于制不锈钢、汽车零件、工具、磁带和录像带等,铬铁矿炼铬过程中部分物质之间的转化关系如图。 原子的价电子排布式为
原子的价电子排布式为___________ ,最高能层上的电子占据的原子轨道轮廓图为___________ 形。
(2)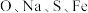 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是___________ 。
(3) 的立体构型为
的立体构型为___________ 形,其中C的杂化轨道类型为___________ 。
(4)K和 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为___________ 。
(5)将 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
写出浅绿色晶体配合物的化学式:___________ 。
(6) 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表___________ (填“ ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为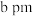 ,
, ,
,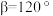 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
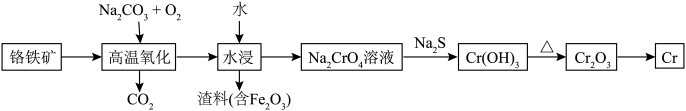
 原子的价电子排布式为
原子的价电子排布式为(2)
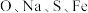 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是(3)
 的立体构型为
的立体构型为(4)K和
 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为(5)将
 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。| 晶体颜色 | 深绿色 | 浅绿色 | 紫色 |
 沉淀的物质的量/ 沉淀的物质的量/ | 1 | 2 | 3 |
(6)
 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表 ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为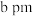 ,
, ,
,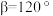 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。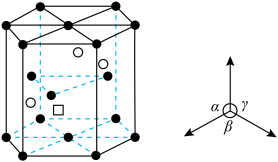
您最近一年使用:0次
解题方法
2 . 元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。回答下列问题:
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为___________ ,砷、硒、溴三种元素电负性由小到大的顺序为___________ (填元素符号), 的空间构型是
的空间构型是___________ 形。
(2)科学家在研究金属矿物质组分的过程中,发现了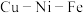 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是___________ 。
(3) 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是___________ , 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 是钴的一种配合物,向
是钴的一种配合物,向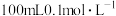 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成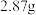 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ ,中心离子的配位数为___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ 。已知该晶体的密度为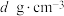 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为
 的空间构型是
的空间构型是(2)科学家在研究金属矿物质组分的过程中,发现了
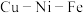 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是(3)
 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是 键和
键和 键数目之比为
键数目之比为(4)
 是钴的一种配合物,向
是钴的一种配合物,向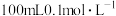 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成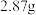 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
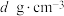 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。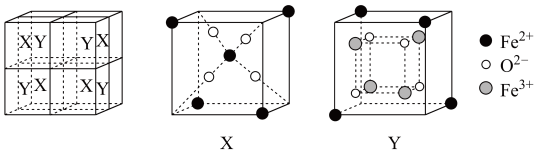
您最近一年使用:0次
解题方法
3 . 新型高温铁基超导材料主要由 、P、
、P、 、
、 等元素组成。回答下列问题:
等元素组成。回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,基态 与基态
与基态 中的未成对电子数之比为
中的未成对电子数之比为___________ 。
(2)向 中嵌入吡啶(
中嵌入吡啶(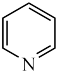 )能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且
)能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且___________ 。
(3)氧、硫、硒为同主族元素, 、
、 和
和 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ (填化学式,下同),键角由大到小的顺序为___________ 。
(4) 晶体的配离子结构如图1所示,其配体
晶体的配离子结构如图1所示,其配体 中的C的杂化方式为
中的C的杂化方式为___________ 杂化,中心离子的配位数为___________ 。

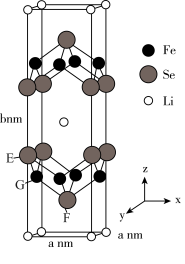
图1 图2
(5) 、
、 、
、 可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为
可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为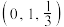 ,F原子的坐标为
,F原子的坐标为 ,G原子的坐标为
,G原子的坐标为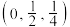 。
。
则距离 原子最近的
原子最近的 原子的个数为
原子的个数为___________ , 原子和
原子和 原子间的最短距离为
原子间的最短距离为___________ (填含a、b的代数式) 。
。
 、P、
、P、 、
、 等元素组成。回答下列问题:
等元素组成。回答下列问题:(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 与基态
与基态 中的未成对电子数之比为
中的未成对电子数之比为(2)向
 中嵌入吡啶(
中嵌入吡啶( )能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且
)能得到具有优异性能的超导材料,吡啶能与水以任意比例互溶,是因为吡啶是极性分子且(3)氧、硫、硒为同主族元素,
 、
、 和
和 的沸点由高到低的顺序为
的沸点由高到低的顺序为(4)
 晶体的配离子结构如图1所示,其配体
晶体的配离子结构如图1所示,其配体 中的C的杂化方式为
中的C的杂化方式为

图1 图2
(5)
 、
、 、
、 可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为
可形成新型超导材料,晶胞棱边夹角均为90°,晶胞结构及晶胞参数如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,E原子的坐标为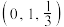 ,F原子的坐标为
,F原子的坐标为 ,G原子的坐标为
,G原子的坐标为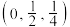 。
。则距离
 原子最近的
原子最近的 原子的个数为
原子的个数为 原子和
原子和 原子间的最短距离为
原子间的最短距离为 。
。
您最近一年使用:0次
2023-08-27更新
|
152次组卷
|
2卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
解题方法
4 . 据《科学》报道,中国科学家首次利用第V A族元素Bi实现超导体(Bi2Te3/NbSe2 )中分段费米面。回答下列问题:
(1)Bi与As位于同主族,基态As原子的价层电子排布式为_____ ,基态Se原子p能级上共有_________ 个电子。
(2)第二周期元素中,第一电离能介于B、N之间的元素是_________ (填元素符号)。
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为_______ ,分子构型为V形的是________ 。
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为___________ 。
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为( ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为_____________________ ;已知晶胞参数为anm,则CdSe的密度为_________________ g·cm-3(列出计算表达式, NA表示阿伏加德罗常数的值)。

(1)Bi与As位于同主族,基态As原子的价层电子排布式为
(2)第二周期元素中,第一电离能介于B、N之间的元素是
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为(
 ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
您最近一年使用:0次
解题方法
5 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
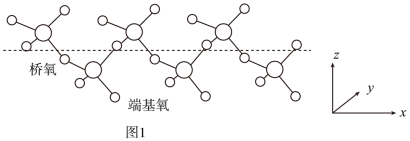
(4)噻吩( )、吡咯(
)、吡咯(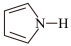 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
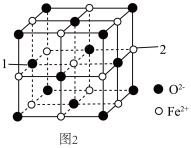
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
333次组卷
|
2卷引用:青海省西宁市2023届高三一模理科综合化学试题
6 . 【化学选修3:物质结构与性质】
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式______________________ ;
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷的通式为_______ ,硅烷中硅采取________ 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________________ ;

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为______________ ;(用元素符号表示)
(4)气态SeO3分子的立体构型为__________ ,与SeO3互为等电子体的一种离子为__________ ;(填化学式)
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________ ;若该晶体的晶胞棱长为a pm,则该合金密度为___________ g/cm3.(列出计算式,不要求计算结果,阿伏加德罗常数的值为NA)
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷的通式为

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为
(4)气态SeO3分子的立体构型为
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为
您最近一年使用:0次



