门捷列夫最早预言了具有半导体特性类硅元素锗(32Ge),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
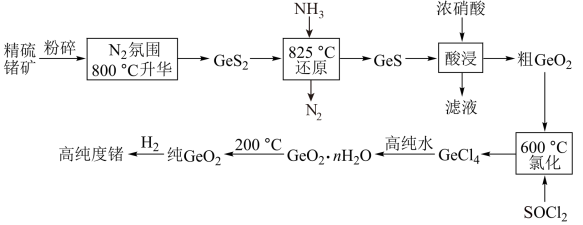
已知:①硅和锗是同主族相邻元素,结构和性质类似;
② 在
在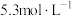 的盐酸中溶解度最小。
的盐酸中溶解度最小。
(1)基态锗原子的价层电子排布式为___________ ,晶体锗的晶体类型是___________ 。
(2)① ,使精硫锗矿在
,使精硫锗矿在 氛围中升华的原因是
氛围中升华的原因是___________ 。
②还原时发生反应:___________ ___________
___________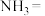 ___________
___________ ___________
___________ ___________
___________ 。配平上述反应的化学方程式,标出电子转移的方向和数目
。配平上述反应的化学方程式,标出电子转移的方向和数目______________ 。
③比较键角:
___________  (选填编号)。其原因是
(选填编号)。其原因是___________ 。
A.> B.< C.=
(3)酸浸时温度不能过高的原因是___________ 。氯化除生成 外,反应还生成一种V形分子,相应的化学方程式为
外,反应还生成一种V形分子,相应的化学方程式为___________ 。 水解得到
水解得到 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是___________ 。
(4) 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②
 在
在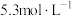 的盐酸中溶解度最小。
的盐酸中溶解度最小。(1)基态锗原子的价层电子排布式为
(2)①
 ,使精硫锗矿在
,使精硫锗矿在 氛围中升华的原因是
氛围中升华的原因是②还原时发生反应:___________
 ___________
___________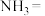 ___________
___________ ___________
___________ ___________
___________ 。配平上述反应的化学方程式,标出电子转移的方向和数目
。配平上述反应的化学方程式,标出电子转移的方向和数目③比较键角:

 (选填编号)。其原因是
(选填编号)。其原因是A.> B.< C.=
(3)酸浸时温度不能过高的原因是
 外,反应还生成一种V形分子,相应的化学方程式为
外,反应还生成一种V形分子,相应的化学方程式为 水解得到
水解得到 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是(4)
 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(选填编号)。
A.n点与p点对应的 相等 相等 |
B.q点无 沉淀生成 沉淀生成 |
| C.通过蒸发可以使溶液由q点变到p点 |
D.加入 可以使溶液由n点变到m点 可以使溶液由n点变到m点 |
更新时间:2023-10-17 11:20:09
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
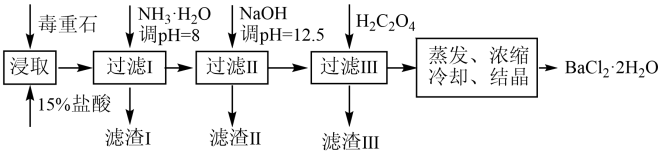
【推荐1】毒重石的主要成分为 (含
(含 、
、 、
、 等杂质)。实验室利用毒重石制备
等杂质)。实验室利用毒重石制备 的流程如下:
的流程如下:
已知:25℃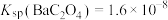 ,
,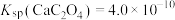
(1)提高毒重石的浸取速率可采取的措施(例举2条)___________ 、___________ 。
(2)加入 调
调 可除去
可除去___________ (填离子符号),滤渣Ⅱ中含___________ (填化学式)。
(3)加入 时应避免过量,原因是
时应避免过量,原因是___________ 。
(4)已知25℃时,将 加入蒸馏水中形成饱和溶液,溶液中的
加入蒸馏水中形成饱和溶液,溶液中的 为
为___________  。
。
 (含
(含 、
、 、
、 等杂质)。实验室利用毒重石制备
等杂质)。实验室利用毒重石制备 的流程如下:
的流程如下:
已知:25℃
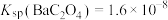 ,
,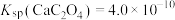
| 离子符号 |  |  |  |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)提高毒重石的浸取速率可采取的措施(例举2条)
(2)加入
 调
调 可除去
可除去(3)加入
 时应避免过量,原因是
时应避免过量,原因是(4)已知25℃时,将
 加入蒸馏水中形成饱和溶液,溶液中的
加入蒸馏水中形成饱和溶液,溶液中的 为
为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g) H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
则X=_____________________ 。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________ (保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________ 。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________ ;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________ 。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+)的关系如右图所示,请回答:
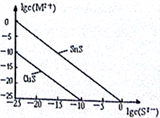
①25℃时Ksp(CuS)=_______________ 。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________ mol/L。
Ⅰ.COS(g)+H2(g)
 H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;I.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| H2CO3 | H2S | |
| Ka1 | 4.4× 10-7 | 1.3×10-7 |
| Ka2 | 4.7× 10-11 | 7.1×10-15 |
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+)的关系如右图所示,请回答:

①25℃时Ksp(CuS)=
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】某废钒渣(主要成分为 ,含有少量
,含有少量 、CaO)为原料生产
、CaO)为原料生产 的工艺流程如图:
的工艺流程如图:
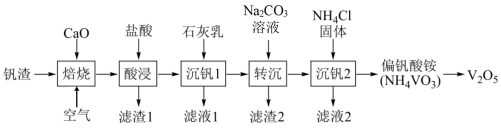
已知: 难溶于水,可溶于盐酸;
难溶于水,可溶于盐酸; 难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
(1)①“酸浸”时与HCl反应的物质除了 、CaO外,还有
、CaO外,还有_______ 。
②“酸浸”后溶液pH约为4,加石灰乳后pH略大于12,则“沉钒1”时沉钒化学方程式为:_______ 。
(2)①“沉钒2”的沉钒率随温度的变化如图所示,温度高于80℃沉钒率下降的原因是_______ 。
②“沉钒2”得到偏钒酸铵( ),若“转沉”后过滤得滤液调节pH后体积为2L,
),若“转沉”后过滤得滤液调节pH后体积为2L,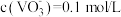 ,为使钒元素的沉降率达到98%,至少应加入
,为使钒元素的沉降率达到98%,至少应加入
_______ mol。(加入 前后溶液体积不变;
前后溶液体积不变;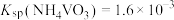 )
)

(3)400℃时,在空气中偏钒酸铵加热分解制备五氧化二钒,分解一段时间后,气体中先检测到 ,随后固体中检测到了
,随后固体中检测到了 杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为_______ 。
 ,含有少量
,含有少量 、CaO)为原料生产
、CaO)为原料生产 的工艺流程如图:
的工艺流程如图:
已知:
 难溶于水,可溶于盐酸;
难溶于水,可溶于盐酸; 难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 、CaO外,还有
、CaO外,还有②“酸浸”后溶液pH约为4,加石灰乳后pH略大于12,则“沉钒1”时沉钒化学方程式为:
(2)①“沉钒2”的沉钒率随温度的变化如图所示,温度高于80℃沉钒率下降的原因是
②“沉钒2”得到偏钒酸铵(
 ),若“转沉”后过滤得滤液调节pH后体积为2L,
),若“转沉”后过滤得滤液调节pH后体积为2L,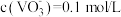 ,为使钒元素的沉降率达到98%,至少应加入
,为使钒元素的沉降率达到98%,至少应加入
 前后溶液体积不变;
前后溶液体积不变;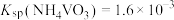 )
)
(3)400℃时,在空气中偏钒酸铵加热分解制备五氧化二钒,分解一段时间后,气体中先检测到
 ,随后固体中检测到了
,随后固体中检测到了 杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐1】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)已知BA5为离子化合物,写出其电子式:_______ 。
(2)B基态原子中能量最高的电子,其电子云在空间有_______ 个方向,原子轨道呈_______ 形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为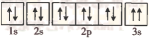 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了__ 。
(4)E位于_______ 族_______ 区,价电子排布式为_______ 。
(5)检验D元素的方法是_______ ,请用原子结构的知识解释产生此现象的原因是_______ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数s电子数少1 |
| C元素原子最外层有2个电子 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)E位于
(5)检验D元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为____________ (用元素符号表示),E2+的基态电子排布式为_________ 。
(2)B、D形成的化合物中属于非极性分子的是______ (填化学式),该分子中心原子的杂化类型是_____________ 。
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为___________________ (填图2中字母a或b),1mol该分子中含有的σ键数目为_______ 。
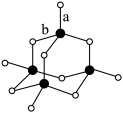
(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为________ 晶体(填晶体类型)。
②E2(CO)8晶体中存在的作用力有______________________ 。
(1)A、C、D的第一电离能由大到小的顺序为
(2)B、D形成的化合物中属于非极性分子的是
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为

(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为
②E2(CO)8晶体中存在的作用力有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的外围电子排布式是_______________ 。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________ ,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________ 。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______ ,与同一个镓原子相连的砷原子构成的立体构型为___________ ,镓采取的杂化方式为________________ 。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________ ,其结构式为_____________ ,硼酸是_______ 元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________ cm,NA表示阿伏伽德罗常数,则该晶体的密度为________ g/cm3。

(1)镓的基态原子的外围电子排布式是
(2)镓与钾、钙元素的第一电离能从大到小依次为
(3)此晶胞中所含的砷原子(白色球)个数为
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】下列各图为几种晶体或晶胞的构型示意图。
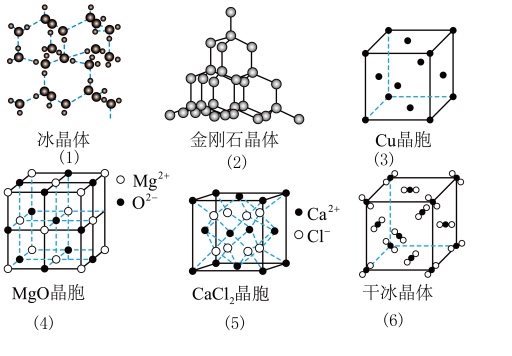
请回答下列问题:(本题前两空用示意图下的序号填空)
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_____________ 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为___________ 。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能__________ (填“大于”或“小于”) MgO晶体的品格能,原因是______________
(4)每个Cu晶胞中实际占有____________ 个Cu原子,CaCl2晶体中Ca2+的配位数为___________ 。
(5)冰的熔点远高于干冰的重要原因是____________________ 。

请回答下列问题:(本题前两空用示意图下的序号填空)
(1)这些晶体中,粒子之间以共价键结合形成的晶体是
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能
(4)每个Cu晶胞中实际占有
(5)冰的熔点远高于干冰的重要原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为___________ , 水解反应的产物为
水解反应的产物为___________ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式___________ , 的分子空间构型为
的分子空间构型为___________ 。 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角___________  中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因___________ 。
(3)已知: 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到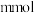 铜粉和
铜粉和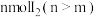 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是___________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,___________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(4)一定条件下, 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
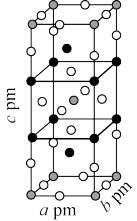
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为___________ 。
(1)
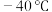 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式 的分子空间构型为
的分子空间构型为 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角 中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)已知:
 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到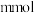 铜粉和
铜粉和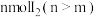 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
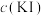 | 实验现象 | |
| 实验Ⅰ |  | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ |  | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ |  |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)一定条件下,
 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
X通常显_____ 价,X 的电负性____ Y 的电负性 (填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________ 。
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________ 。
(3)实验证明:KCl、MgO、CaO、TiN 这四种晶体的结构与NaCl 晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
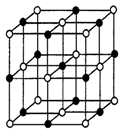
则这四种离子晶体的熔点从高到低的顺序是_______ 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______ 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2 中,适合作录音带磁粉原料的是_________ 。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/(kJ/mol ) | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
X通常显
(2)紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
| 共价键 | C-C键 | C-N键 | C-S键 |
| 键能/(kJ/mol) | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是
(3)实验证明:KCl、MgO、CaO、TiN 这四种晶体的结构与NaCl 晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ.mol-1 ) | 786 | 715 | 3401 |

则这四种离子晶体的熔点从高到低的顺序是
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2 中,适合作录音带磁粉原料的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某小组探究CuCl2溶液和Na2SO3溶液反应的主要产物,开展如下活动。
[实验准备]
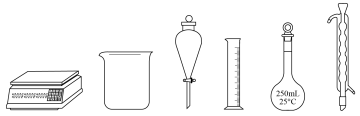
(1)用亚硫酸钠固体配制100mL0.2mol⋅L-1Na2SO3溶液,下列仪器中无需使用的有________ (填名称)。
小组同学预测Na2SO3溶液与CuCl2溶液反应的产物可能有CuSO3、 、Cu2SO3和CuCl。
、Cu2SO3和CuCl。
[实验探究]
取1mL0.2mol⋅L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即得到橙黄色沉淀。静置3分钟,沉淀颜色变浅并伴有少量白色沉淀产生。振荡试管,1min后,橙黄色沉淀全部变成了白色沉淀。
资料:ⅰ.含铜元素沉淀的颜色
CuSO3——绿色 ——蓝色 Cu2SO3——红色 CuCl——白色
——蓝色 Cu2SO3——红色 CuCl——白色
ⅱ. 、
、 在水中分别呈无色和深蓝色。
在水中分别呈无色和深蓝色。
(2)检验实验后溶液中含有Cl-的实验操作:取少量上层清液于试管中,________ 。(将操作和现象补充完整)。
(3)为证明实验产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:取白色沉淀于试管中,加入过量的浓氨水,白色沉淀溶解得到无色溶液,放置一段时间变为淡蓝色溶液,再过一段时间溶液变为深蓝色,该实验总反应的离子方程式________ 。
(4)经检验,橙黄色沉淀的成分为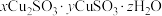 ,实验中橙黄色沉淀向白色沉淀转化时间较短,从沉淀转化条件分析,为利于橙黄色沉淀的收集,可将CuCl2溶液替换为
,实验中橙黄色沉淀向白色沉淀转化时间较短,从沉淀转化条件分析,为利于橙黄色沉淀的收集,可将CuCl2溶液替换为________ 溶液。
(5)实验中,CuCl2溶液与Na2SO3溶液混合后立即得到橙黄色沉淀,最终橙黄色沉淀全部转化为白色沉淀的原因是________ 。
(6)请设计用Na2SO3溶液制备Na2S2O3⋅5H2O的实验方案:称取稍过量硫粉放入烧杯中,________ ,用滤纸吸干。
已知:①在液体沸腾状态下,可发生反应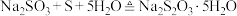 。
。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
[实验准备]
(1)用亚硫酸钠固体配制100mL0.2mol⋅L-1Na2SO3溶液,下列仪器中无需使用的有
小组同学预测Na2SO3溶液与CuCl2溶液反应的产物可能有CuSO3、
 、Cu2SO3和CuCl。
、Cu2SO3和CuCl。[实验探究]
取1mL0.2mol⋅L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即得到橙黄色沉淀。静置3分钟,沉淀颜色变浅并伴有少量白色沉淀产生。振荡试管,1min后,橙黄色沉淀全部变成了白色沉淀。
资料:ⅰ.含铜元素沉淀的颜色
CuSO3——绿色
 ——蓝色 Cu2SO3——红色 CuCl——白色
——蓝色 Cu2SO3——红色 CuCl——白色ⅱ.
 、
、 在水中分别呈无色和深蓝色。
在水中分别呈无色和深蓝色。(2)检验实验后溶液中含有Cl-的实验操作:取少量上层清液于试管中,
(3)为证明实验产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:取白色沉淀于试管中,加入过量的浓氨水,白色沉淀溶解得到无色溶液,放置一段时间变为淡蓝色溶液,再过一段时间溶液变为深蓝色,该实验总反应的离子方程式
(4)经检验,橙黄色沉淀的成分为
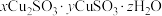 ,实验中橙黄色沉淀向白色沉淀转化时间较短,从沉淀转化条件分析,为利于橙黄色沉淀的收集,可将CuCl2溶液替换为
,实验中橙黄色沉淀向白色沉淀转化时间较短,从沉淀转化条件分析,为利于橙黄色沉淀的收集,可将CuCl2溶液替换为(5)实验中,CuCl2溶液与Na2SO3溶液混合后立即得到橙黄色沉淀,最终橙黄色沉淀全部转化为白色沉淀的原因是
(6)请设计用Na2SO3溶液制备Na2S2O3⋅5H2O的实验方案:称取稍过量硫粉放入烧杯中,
已知:①在液体沸腾状态下,可发生反应
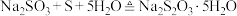 。
。②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
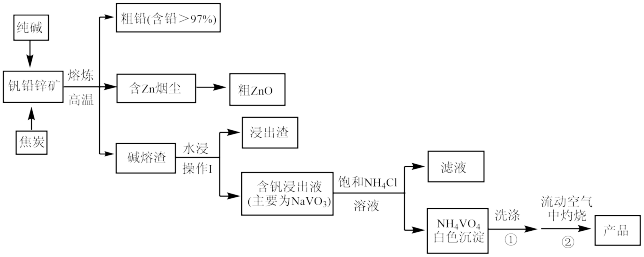
【推荐2】V2O5可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,具有强氧化性,属于两性氧化物。某研究小组将从钒铅锌矿(主要含有V2O5、PbO、ZnO、CaO)中提取V2O5及回收铅、锌等金属。工艺流程如下图所示:
已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3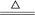 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的________ 反应; V2O5与纯碱反应的化学方程式为_______________________ 。
(2)流程中操作I的名称是_______________________ 。
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约______ % 较为合适。

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是___________ 。
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是_________________________ 。
(6)在洗涤①操作时,可选用的洗涤剂________ (填选项字母)。
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因_____________________ 。

已知:NH4VO3是白色粉末,可溶于热水,微溶于冷水,不溶于乙醇、乙醚。2NH4VO3
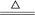 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O请回答:
(1)钒铅锌矿高温熔炼时,生成金属铅的反应属于基本反应类型中的
(2)流程中操作I的名称是
(3)焦炭用量对还原熔炼效果的影响如下左图所示。分析图像可知,焦炭用量应取矿石质量的约

(4)钒浸出过程中,液固比(液体质量:固体质量)对钒浸出率的影响如上右图所示。分析图像可知,浸出过程的液固比最合适的比例约为2:1,理由是
(5)为制取纯度较高的V2O5,往含钒浸出液(主要为NaVO3)中加NH4Cl溶液,该反应的化学方程式是
(6)在洗涤①操作时,可选用的洗涤剂
A.乙醚 B.1% NH4Cl 溶液 C.热水 D.冷水
(7)在灼烧②操作时,需在流动空气中灼烧的可能原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
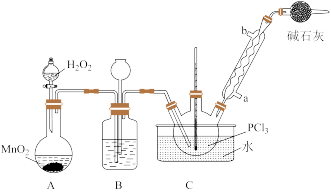
资料:① Ag+ + SCN- =AgSCN↓,Ksp(AgCl) >Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
(1)PCl3分子中各原子均满足8电子稳定结构,则PCl3的电子式为____ 。
(2)B中所盛的试剂是____ ,干燥管的作用是________ 。
(3)POCl3遇水反应的化学方程式为_____________ 。
(4)反应温度要控制在60~65℃,原因是:__________ 。
II.工业上可用氯化水解法生产三氯氧磷,工艺流程如下:
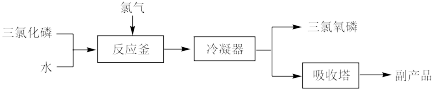
(5)氯化水解法生产三氯氧磷的化学方程式为____ 。
(6)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
a、准确称取30.7 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol·L-1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以X为指示剂,用0.2 mol·L-1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤c中加入硝基苯的作用是____ 。
②步骤d中X为______ 。
A FeCl2 B NH4Fe(SO4)2 C 淀粉 D 甲基橙
③三氯氧磷产品中Cl元素的质量百分含量为____ 。
I.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:① Ag+ + SCN- =AgSCN↓,Ksp(AgCl) >Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)B中所盛的试剂是
(3)POCl3遇水反应的化学方程式为
(4)反应温度要控制在60~65℃,原因是:
II.工业上可用氯化水解法生产三氯氧磷,工艺流程如下:

(5)氯化水解法生产三氯氧磷的化学方程式为
(6)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
a、准确称取30.7 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol·L-1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以X为指示剂,用0.2 mol·L-1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤c中加入硝基苯的作用是
②步骤d中X为
A FeCl2 B NH4Fe(SO4)2 C 淀粉 D 甲基橙
③三氯氧磷产品中Cl元素的质量百分含量为
您最近一年使用:0次



