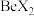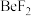A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为____________ (用元素符号表示),E2+的基态电子排布式为_________ 。
(2)B、D形成的化合物中属于非极性分子的是______ (填化学式),该分子中心原子的杂化类型是_____________ 。
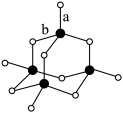
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为___________________ (填图2中字母a或b),1mol该分子中含有的σ键数目为_______ 。
(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为________ 晶体(填晶体类型)。
②E2(CO)8晶体中存在的作用力有______________________ 。
(1)A、C、D的第一电离能由大到小的顺序为
(2)B、D形成的化合物中属于非极性分子的是
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为

(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为
②E2(CO)8晶体中存在的作用力有
更新时间:2016-12-09 16:37:43
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。
(1)Fe2+的电子排布式是____________________________ 。
(2)液态SO2可发生自偶电离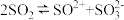 ,SO2属于
,SO2属于_____________ (选填“极性分子”或“非极性分子”), 的空间构型是
的空间构型是___________________ 。
(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______ 种。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________ 。乙硫醇的沸点比乙醇的沸点低,原因是___________ 。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是______________ ,其密度为_____________ g/cm3(阿伏加 德罗常数的值用NA表示)。

(1)Fe2+的电子排布式是
(2)液态SO2可发生自偶电离
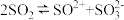 ,SO2属于
,SO2属于 的空间构型是
的空间构型是(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为__ 。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是__ (填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素称为__ 。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力__ (“减弱”或“不变”)。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_ ;
②CH4和HCHO比较,键角较大的是__ ,主要原因是__ 。
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素称为
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是
②CH4和HCHO比较,键角较大的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】铝酸铋[Bi(AlO2)3]主要用作抗酸药及抗溃疡药,具有中和胃酸和收敛作用。以辉铋矿(主要成分为 Bi2S3,含有: 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:

已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于___________ 区,铋的价层电子排布式为___________ 。
(2)“浸取”过程中,提高浸出率的措施有___________ 。(写一条即可)
(3) “还原”时, 加入铋的目的是___________ 。
(4)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为___________ 。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
 等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
等杂质)为原料制备铝酸铋的一种工艺流程如图所示:
已知:“沉淀”步骤中,不能出现Fe3+,否则后续Bi(OH)3沉淀中会混有Fe(OH)3杂质。请回答下列问题:
(1)铋位于第六周期,且与氮同主族,则铋元素在元素周期表中属于
(2)“浸取”过程中,提高浸出率的措施有
(3) “还原”时, 加入铋的目的是
(4)已知进入“碱溶”步骤的物质为经过充分洗涤的Cu(OH)2和 Bi(OH)3固体混合物,为检验是否洗涤干净,可选择的试剂为
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.BaCl2溶液
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是___________ ,M在元素周期表中的位置是___________ ,元素B、D、E的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为___________ ;化合物ABD的结构式为___________ ,其中B原子的杂化方式为___________ 。
(3)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的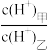 =
=___________ ;乙溶液中所含离子的物质的量浓度由大到小的顺序是___________ 。
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为___________ ;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是___________ 。
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________ 。
请回答下列问题:
(1)基态G原子的核外电子排布式是
(2)元素A和E组成的阳离子空间构型为
(3)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
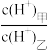 =
=(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】AA705合金(含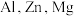 和
和 )几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
(1) 和
和 中阳离子基态核外电子排布式为
中阳离子基态核外电子排布式为_____________________ ,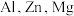 三种元素的第一电离能由大到小为
三种元素的第一电离能由大到小为_____________________ ;
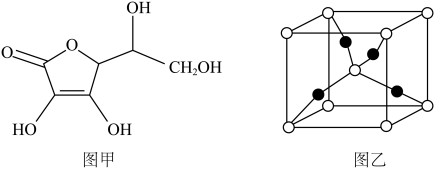
(2)以 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______________ ,推测抗坏血酸在水中的溶解性:_______________ (填“难溶于水”或“易溶于水”),一个 晶胞(见图2)中,
晶胞(见图2)中, 原子的数目为
原子的数目为_______________ ;
(3) 和
和 等配体都能与
等配体都能与 形成配离子。
形成配离子。 含
含______  键,中心离子的配位数为
键,中心离子的配位数为______________ ;
(4)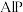 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知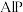 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
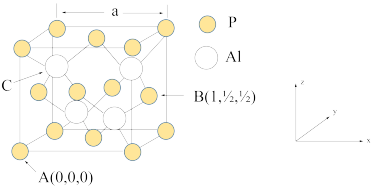
①磷化铝的晶体类型为______________ ,
②A、B点的原子坐标如图所示,则C点的原子坐标为___________ ,
③磷化铝的晶胞参数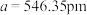 ,其密度为
,其密度为____________  (列出计算式即可,用
(列出计算式即可,用 表示阿伏加 德罗常数的值);
表示阿伏加 德罗常数的值);
(5) 具有对称的立体构型,
具有对称的立体构型, 中的两个
中的两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为________________ 。
 和
和 )几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:(1)
 和
和 中阳离子基态核外电子排布式为
中阳离子基态核外电子排布式为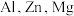 三种元素的第一电离能由大到小为
三种元素的第一电离能由大到小为(2)以
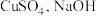 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为 晶胞(见图2)中,
晶胞(见图2)中, 原子的数目为
原子的数目为
(3)
 和
和 等配体都能与
等配体都能与 形成配离子。
形成配离子。 含
含 键,中心离子的配位数为
键,中心离子的配位数为(4)
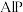 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知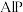 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数
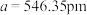 ,其密度为
,其密度为 (列出计算式即可,用
(列出计算式即可,用 表示阿伏加 德罗常数的值);
表示阿伏加 德罗常数的值);(5)
 具有对称的立体构型,
具有对称的立体构型, 中的两个
中的两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】氮是地球上极为丰富的元素,回答下列问题:
(1)氮化锂(Li3N)晶体中氮以N3-存在,基态N3-的电子排布式为_______ 。
(2)胸腺嘧啶是构成DNA的一种生物碱,结构简式如图:
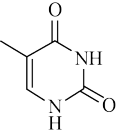
其构成元素(H元素除外)的第一电离能由小到大的顺序为_______ 。胸腺嘧啶分子中σ键和π键的比值为_______ 。
(3)叠氮化钠(NaN3)常用作汽车安全气囊中的药剂,3mol叠氮化钠受撞击会生成4mol氮气和一种离子化合物,写出此反应的化学方程式_______ 。写出叠氮酸根( )的一种等电子体
)的一种等电子体_______ 。
(4)(CH3)3NH+和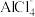 可形成离子液体,阳离子中氮原子的杂化方式为
可形成离子液体,阳离子中氮原子的杂化方式为_______ ,阴离子的几何构型为_______ ,阴离子中存在的化学键有_______ 。
(5)已知X+中所有电子刚好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞如图所示:

X的元素符号是_______ ,若棱上的X+与N3-相互接触,r(X+)=a,r(N3-)=b,则该晶胞的空间利用率为_______ 。(列出计算式)。
(1)氮化锂(Li3N)晶体中氮以N3-存在,基态N3-的电子排布式为
(2)胸腺嘧啶是构成DNA的一种生物碱,结构简式如图:

其构成元素(H元素除外)的第一电离能由小到大的顺序为
(3)叠氮化钠(NaN3)常用作汽车安全气囊中的药剂,3mol叠氮化钠受撞击会生成4mol氮气和一种离子化合物,写出此反应的化学方程式
 )的一种等电子体
)的一种等电子体(4)(CH3)3NH+和
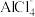 可形成离子液体,阳离子中氮原子的杂化方式为
可形成离子液体,阳离子中氮原子的杂化方式为(5)已知X+中所有电子刚好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞如图所示:

X的元素符号是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】请回答以下问题:
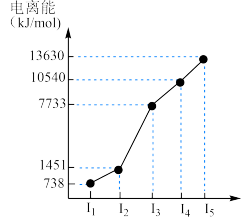
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________ 。
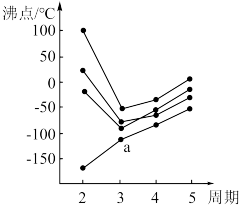
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______ 。
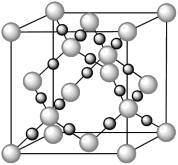
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________ (填“高”或“低”),该晶体中碳原子轨道的杂化类型为______ 。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____ (填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________ 。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________ (若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________ ;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________ ;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________ 。
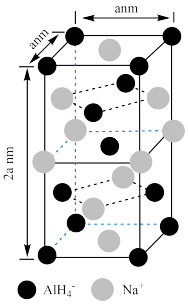
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________ 个;NaAlH4晶体的密度为___________ g·cm-3(用含a的代数式表示)。
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为

(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体

(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
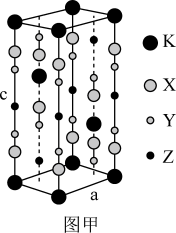
【推荐2】氟代硼铍酸钾晶体KBBF(KBe2BO3F2)是一种非线性光学晶体材料,广泛应用于激光、光刻录等领域,长方体晶胞如下图甲所示(其中K原子已经给出,氧原子略去)。回答下列问题:
(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
(2)K2O2的阴阳离子比为___________ 。第四周期,与基态钾原子最外层电子数相同的原子有___________ (填元素符号)。
(3)OF2分子中氧原子的杂化类型是___________ ,空间构型为___________ 。
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是___________ 。
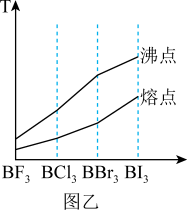
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是___________ 。
(6)指出图甲中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为apm和cpm,则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏加德罗常数的值)。

(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
A. | B.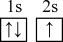 | C.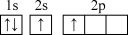 | D.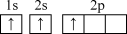 |
(3)OF2分子中氧原子的杂化类型是
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是

(6)指出图甲中代表硼原子的字母为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】 族元素及其化合物在材料等方面有重要用途。
族元素及其化合物在材料等方面有重要用途。
(1)碳的一种单质的结构如图所示。该单质的晶体类型为___________ 晶体,依据电子云的重叠方式,原子间存在的共价键类型有___________ 。

(2)石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是__________
(3)碳的另一种单质 和可以与钾形成低温超导化合物,晶体结构如下图所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为
和可以与钾形成低温超导化合物,晶体结构如下图所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为___________ ;其晶胞参数为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,则晶体的密度为
表示,则晶体的密度为___________  (只需列出式子,无需化简)。
(只需列出式子,无需化简)。

(4)相同温度下,2-硝基苯酚( )的酸性小于4-硝基苯酚(
)的酸性小于4-硝基苯酚( )的酸性,其原因是
)的酸性,其原因是___________ 。
(5)四卤化硅 的沸点和四卤化锡
的沸点和四卤化锡 的熔点如下表所示。
的熔点如下表所示。
① 的沸点依F、
的沸点依F、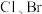 、I次序升高的原因是
、I次序升高的原因是___________ 。
②结合 的熔点的变化规律,可推断:依F、
的熔点的变化规律,可推断:依F、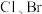 、I次序,
、I次序, 中的化学键的离子性
中的化学键的离子性___________ 、共价性___________ (填“增强”、“不变”或“减弱”)。请从原子结构角度解释所推断的结论:___________ 。
③已知, 发生水解反应的机理如图:
发生水解反应的机理如图:

下列叙述正确的是_______
A. 的角与白磷(P4)的键角相同
的角与白磷(P4)的键角相同
B. 脱水后加热分解得到的晶体中每个
脱水后加热分解得到的晶体中每个 可构成12个12元环
可构成12个12元环
C. 属于共价晶体
属于共价晶体
D. 不能按照上述机理发生水解反应,原因是C的原子半径小
不能按照上述机理发生水解反应,原因是C的原子半径小
④ 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到
)反应可以得到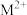 ,其结构如下图所示。N-甲基咪唑分子中碳原子的杂化轨道类型为
,其结构如下图所示。N-甲基咪唑分子中碳原子的杂化轨道类型为___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个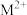 中含有
中含有___________ 个σ键。

 族元素及其化合物在材料等方面有重要用途。
族元素及其化合物在材料等方面有重要用途。(1)碳的一种单质的结构如图所示。该单质的晶体类型为

(2)石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是__________
| A.石墨烯是一种强度很高的材料 | B.石墨烯是电的良导体而石墨烷则为绝缘体 |
| C.石墨烯与石墨烷均为高分子化合物 | D.石墨烯与 制得石墨烷的反应属于加成反应 制得石墨烷的反应属于加成反应 |
(3)碳的另一种单质
 和可以与钾形成低温超导化合物,晶体结构如下图所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为
和可以与钾形成低温超导化合物,晶体结构如下图所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,则晶体的密度为
表示,则晶体的密度为 (只需列出式子,无需化简)。
(只需列出式子,无需化简)。
(4)相同温度下,2-硝基苯酚(
 )的酸性小于4-硝基苯酚(
)的酸性小于4-硝基苯酚( )的酸性,其原因是
)的酸性,其原因是(5)四卤化硅
 的沸点和四卤化锡
的沸点和四卤化锡 的熔点如下表所示。
的熔点如下表所示。| 物质 |  |  |  |  |
| 沸点/℃ | -85.7 | 56.9 | 134.8 | 187.5 |
| 物质 | 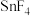 |  |  | 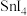 |
| 熔点/℃ | 705 | -33 | 31 | 144.5 |
 的沸点依F、
的沸点依F、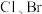 、I次序升高的原因是
、I次序升高的原因是②结合
 的熔点的变化规律,可推断:依F、
的熔点的变化规律,可推断:依F、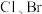 、I次序,
、I次序, 中的化学键的离子性
中的化学键的离子性③已知,
 发生水解反应的机理如图:
发生水解反应的机理如图:
下列叙述正确的是
A.
 的角与白磷(P4)的键角相同
的角与白磷(P4)的键角相同B.
 脱水后加热分解得到的晶体中每个
脱水后加热分解得到的晶体中每个 可构成12个12元环
可构成12个12元环C.
 属于共价晶体
属于共价晶体D.
 不能按照上述机理发生水解反应,原因是C的原子半径小
不能按照上述机理发生水解反应,原因是C的原子半径小④
 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到
)反应可以得到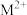 ,其结构如下图所示。N-甲基咪唑分子中碳原子的杂化轨道类型为
,其结构如下图所示。N-甲基咪唑分子中碳原子的杂化轨道类型为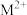 中含有
中含有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】2023年6月,科学家首次合成含铍-铍键的固态化合物,相关成果发表于《科学》杂志。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题:
(2)固态双铍化合物的化学式为______ ,它含有______ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(3)卤化铍的熔点如表所示:
① 属于
属于______ (填“极性”或“非极性”)分子。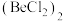 中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为
中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为______ (标出配位键)。
③ 、
、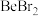 、
、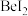 的熔点依次升高的原因是
的熔点依次升高的原因是______ 。
(4)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。设晶胞边长为a pm,用 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为______  (用含a和
(用含a和 的式子表示)。
的式子表示)。

A. | B. | C.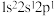 | D.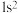 |
(2)固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(3)卤化铍的熔点如表所示:
|
|
|
|
|
熔点/℃ | 552 | 399 | 488 | 510 |
 属于
属于②氯化铍在气态时存在 分子(a)和二聚分子
分子(a)和二聚分子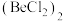 (b),固态时则具有如图所示的链状结构(c)
(b),固态时则具有如图所示的链状结构(c)
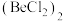 中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为
中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为③
 、
、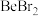 、
、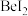 的熔点依次升高的原因是
的熔点依次升高的原因是(4)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。设晶胞边长为a pm,用
 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。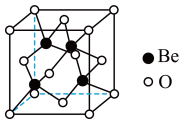
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释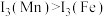 的主要原因:
的主要原因:_______ 。
(4)H、C、O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式)。
②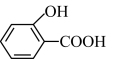 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)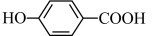 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
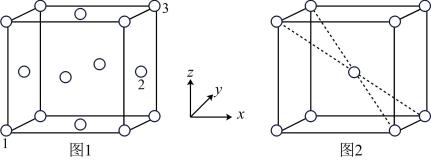
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,则该晶胞的空间利用率(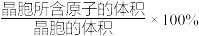 )为
)为_______ (用含π的式子表示)%。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 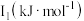 |  | 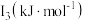 |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
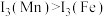 的主要原因:
的主要原因:(4)H、C、O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,则该晶胞的空间利用率(
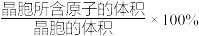 )为
)为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】用元素周期表中的部分元素及其化合物回答下列问题。
(1)C的基态原子的电子排布式_______ ;Zn在周期表中的位置是_______ 。
(2)C、N、O原子电负性由小到大顺序为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
(3) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ ,C原子的杂化方式为_______ , 分子为
分子为_______ 。(填“极性分子”或“非极性分子”)
(4)Au与NaCN溶液在 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:_______ 。
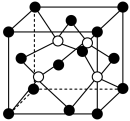
(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与 等距且最近的
等距且最近的 有
有_______ 个。已知该晶胞参数为dnm,晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
_______  。
。
(1)C的基态原子的电子排布式
(2)C、N、O原子电负性由小到大顺序为
 的空间构型为
的空间构型为(3)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为 分子为
分子为(4)Au与NaCN溶液在
 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与
 等距且最近的
等距且最近的 有
有 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
 。
。
您最近一年使用:0次