解题方法
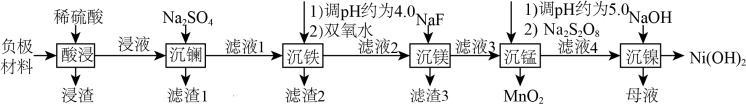
1 . 氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、MnO2、石墨粉等)进行湿法处理的流程如图所示:
②Ksp(MgF2)=6.4 ;
;
③H2SO4第一步完全电离,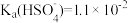 。
。
回答下列问题:
(1)Ni2+的价层电子排布式为_____________ 。
(2)能提高“酸浸”效率的措施有_____________ (任写一种)。
(3)若滤渣1的成分为 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因_________________ 。
(5)“沉镁”后滤液3中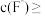
__________  (溶液中离子浓度
(溶液中离子浓度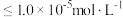 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。
(6) 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为_________________ 。
(7)“沉镍”所用试剂不宜选用氨水的原因为_________________ ,母液中可提取出的循环利用的物质为_____________ (填化学式)。
②Ksp(MgF2)=6.4
 ;
;③H2SO4第一步完全电离,
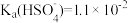 。
。回答下列问题:
(1)Ni2+的价层电子排布式为
(2)能提高“酸浸”效率的措施有
(3)若滤渣1的成分为
 ,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因
,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图所示。试分析pH<2.0时沉镧率降低的原因 
| A.KSCN溶液 |
| B.K3[Fe(CN)6]溶液 |
| C.NaOH溶液 |
| D.KSCN溶液和氯水 |
(5)“沉镁”后滤液3中
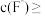
 (溶液中离子浓度
(溶液中离子浓度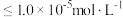 时认为该离子沉淀完全)。
时认为该离子沉淀完全)。(6)
 中存在过氧键(-O-O-),“沉锰”反应的离子方程式为
中存在过氧键(-O-O-),“沉锰”反应的离子方程式为(7)“沉镍”所用试剂不宜选用氨水的原因为
您最近一年使用:0次
2 . 我国科学家用粗氢氧化高钴 制备硫酸钴晶体(
制备硫酸钴晶体(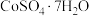 ),其工艺流程如下:
),其工艺流程如下:

已知:ⅰ.还原浸出液中的阳离子有: 、
、 、
、 和
和 等
等
ⅱ.部分物质的溶度积常数(25℃)
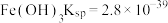
ⅲ.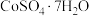 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大
(1)Co元素位于元素周期表的_______ 区,基态Co原子的核外电子排布式为_______ 。
(2)浸出 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为_______ 。
(3)写出“氧化沉铁”的离子方程式_______ ,25℃时,浊液中铁离子浓度为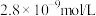 ,此时溶液
,此时溶液
_______ 。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为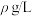 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗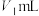 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。
计算样品中钴含量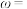
_______ (以钴的质量分数 计)。
计)。
(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高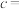
_______  (列出计算式)。
(列出计算式)。

 制备硫酸钴晶体(
制备硫酸钴晶体(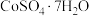 ),其工艺流程如下:
),其工艺流程如下:
已知:ⅰ.还原浸出液中的阳离子有:
 、
、 、
、 和
和 等
等ⅱ.部分物质的溶度积常数(25℃)

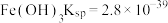
ⅲ.
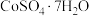 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大(1)Co元素位于元素周期表的
(2)浸出
 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为(3)写出“氧化沉铁”的离子方程式
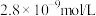 ,此时溶液
,此时溶液
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为
 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为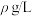 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗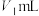 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。计算样品中钴含量
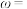
 计)。
计)。(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高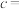
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、W是原子序数依次增大的前20号元素,常温下只有一种元素的单质为气态。基态X原子s轨道上的电子数是p轨道上的2倍,Y的简单氢化物与其最高价含氧酸反应会产生白烟,Z与X形成的某种化合物常温下为液体,基态W原子有1个未成对电子。下列说法错误的是
| A.氢化物的沸点:Y>Z>X |
| B.电负性:Y>Z>X>W |
| C.原子半径:W>Z>X>Y |
| D.上述元素形成的某种化合物的溶液可用于检测Fe3+ |
您最近一年使用:0次
4 . 钴及其化合物具有广泛的用途,我国古代用的陶器釉料中就含有氧化钴。随着科技的不断发展,钴及其化合物成为制造合金、陶瓷颜料、催化剂、电池的重要原料之一,钴被也称为“工业味精”和“工业牙齿”,是重要的战略资源之一。回答下列问题。
(1)基态钴原子的价层电子排布式为_____ ,钴成为阳离子时首先失去_______ 轨道电子。
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子___________ (填“大”“小”或“相同”),其原因为___________ 。
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
① 中N的杂化方式为
中N的杂化方式为___________ 。
②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是____________ 。
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是___________ (填序号)。
A.NH3 B. C.
C. D.H2O
D.H2O
(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为___________ ,晶体中正四面体空隙数与正八面体空隙数之比为___________ 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为___________ g·cm-3(用含a和NA的代数式表示)。
(1)基态钴原子的价层电子排布式为
(2)配合物[Co(NH3)6]2+中的H-N-H的键角比游离的NH3分子
(3)[Co(NH3)4CO3]NO3可用于制备激光起爆器,制取[Co(NH3)4CO3]NO3的反应原理为:4Co(NO3)2+12NH3+4(NH4)2CO3+O2=4[Co(NH3)4CO3]NO3,+4NH4NO3+2H2O
①
 中N的杂化方式为
中N的杂化方式为②[Co(NH3)4CO3]NO3中与Co(III)形成配位键的原子是
③多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离城π键”,下列物质中存在“离城π键”的是
A.NH3 B.
 C.
C. D.H2O
D.H2O(4)Co3O4晶体的晶胞如图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Co3O4中有一半的Co3+填充在正四面体空隙中,Co2+和另一半Co3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为
您最近一年使用:0次
名校
解题方法
5 . 高效节能、寿命长的半导体照明产品正在引领照明行业的绿色变革,而氮化镓(GaN)的研制是实现半导体照明的核心技术和基础,当前我国在第三代半导体材解研制方面走在世界的前列。回答下列有关问题。
(1)基态Ga原子的价层电子排布式为_______ 。
(2)GaN在加热条件下与NaOH溶液发生如下反应:CaN+OH-+H2O=GaO +NH3↑。
+NH3↑。
①基态N、O分别失去一个电子时,需要吸收能量更多的是_______ ,判断的理由是_______ 。
②GaO 在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为
在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为_______ ,1mol[Ga(H2O)6]3+中所含有的σ键数目为_______ , 与H2O相比,键角
与H2O相比,键角
_______ H2O(填“>”或“<”)。
(3)GaN的一种晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①氮化镓中镓原子的杂化方式为_______ ,与同一个Ga原子相连的N原子构成的空间构型为_______ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如下图所示,则2、3、4原子的分数坐标不可能的是_______ (填序号)。

a.(0.75,0.75,0.25) b.(0.75,0.25,0.75)
c.(0.25,0.25,0.25) d.(0.25,0.75,025)
③GaN晶体中N和N的原子核间距为apm,GaN的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______ g·cm-3。
(1)基态Ga原子的价层电子排布式为
(2)GaN在加热条件下与NaOH溶液发生如下反应:CaN+OH-+H2O=GaO
 +NH3↑。
+NH3↑。①基态N、O分别失去一个电子时,需要吸收能量更多的是
②GaO
 在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为
在高氯酸的热溶液中可以生成化合物[Ga(H2O)6](ClO4)3,该化合物中提供孤电子对形成配位键的原子为 与H2O相比,键角
与H2O相比,键角
(3)GaN的一种晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①氮化镓中镓原子的杂化方式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如下图所示,则2、3、4原子的分数坐标不可能的是

a.(0.75,0.75,0.25) b.(0.75,0.25,0.75)
c.(0.25,0.25,0.25) d.(0.25,0.75,025)
③GaN晶体中N和N的原子核间距为apm,GaN的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
2022-04-19更新
|
521次组卷
|
2卷引用:甘肃省2022届高三第二次高考诊断考试(二模)理科综合化学试题



