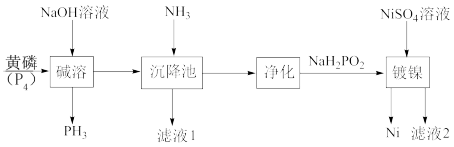
次磷酸钠(NaH2PO2)是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠(NaH2PO2)广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
(1)基态Ni原子的核外电子排布式为_____ ,PH3的分子空间构型为_____ 。
(2)“碱溶”过程中,发生反应化学方程式为_____ 。
(3)“沉降池”中通入氨气的目的是_____ ,“净化”操作需要过滤、洗涤、干燥,洗涤时,选用的洗涤剂为_____ 。
(4)“滤液2”经分离提纯可以得H3PO2,写出“镀镍”过程发生的离子反应方程式_____ ,充分反应后,向“滤液2”中,加入适量 悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
_____ [已知: ,
, ]
]
(5)Ni和La的合金是目前使用广泛的储氢材料,该合金的晶胞结构如图所示。_____ 。
②已知该晶体晶胞底面边长为apm,高为cpm,设 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为_____  (用含a、c、
(用含a、c、 的代数式表示)
的代数式表示)
(1)基态Ni原子的核外电子排布式为
(2)“碱溶”过程中,发生反应化学方程式为
(3)“沉降池”中通入氨气的目的是
(4)“滤液2”经分离提纯可以得H3PO2,写出“镀镍”过程发生的离子反应方程式
 悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
悬浊液,生成CaSO4和CaHPO4混合沉淀,此时
 ,
, ]
](5)Ni和La的合金是目前使用广泛的储氢材料,该合金的晶胞结构如图所示。
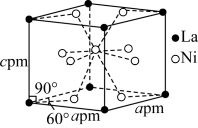
②已知该晶体晶胞底面边长为apm,高为cpm,设
 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)
的代数式表示)
更新时间:2023-09-15 18:30:05
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】煤燃烧排放的烟气中 主要含
主要含 、
、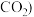 的
的 形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:


(1)采用 烟气脱硫可得到较好的效果.已知下列反应:
烟气脱硫可得到较好的效果.已知下列反应:
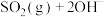
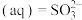
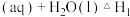

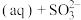
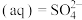
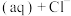
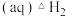
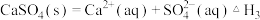
则反应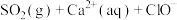

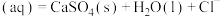
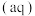 的
的
______ .
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的 与
与 溶于水所得溶液中
溶于水所得溶液中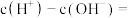
______  填字母编号
填字母编号 .
.
A.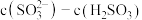
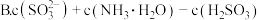
C.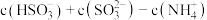
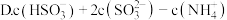
(3)烟气在较高温度经如图1方法脱除 ,并制得
,并制得 .
.
①在阴极放电的物质是______ .
②在阳极生成 的电极反应式是
的电极反应式是 ______ .
③已知室温下,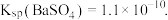 将脱除
将脱除 后制得的
后制得的 配成
配成 的
的 溶液,与
溶液,与 的
的  溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的  ,则
,则  溶液与
溶液与  溶液的体积比为
溶液的体积比为 ______  欲使溶液中
欲使溶液中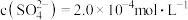 ,则应保持溶液中
,则应保持溶液中 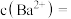
______  .
.
(4)一定条件下,用 、NiO或
、NiO或 作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
作催化剂,利用如下反应回收燃煤烟气中的硫.反应为: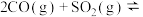
 其他条件相同、催化剂不同时,
其他条件相同、催化剂不同时, 的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择
的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理 选填序号
选填序号 ;
;
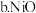
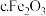
选择该催化剂的理由是:______ .
某科研小组用选择的催化剂,在 时,研究了
时,研究了 :
: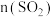 分别为1:1、3:1时,
分别为1:1、3:1时, 转化率的变化情况
转化率的变化情况 图
图 则图3中表示
则图3中表示 :
: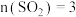 :1的变化曲线为
:1的变化曲线为 ______ .
 主要含
主要含 、
、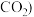 的
的 形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:

(1)采用
 烟气脱硫可得到较好的效果.已知下列反应:
烟气脱硫可得到较好的效果.已知下列反应: 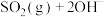

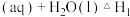

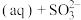

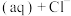
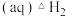
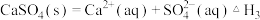
则反应
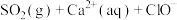

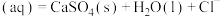
 的
的
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的
 与
与 溶于水所得溶液中
溶于水所得溶液中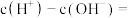
 填字母编号
填字母编号 .
.A.
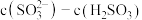
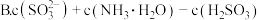
C.
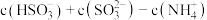
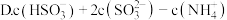
(3)烟气在较高温度经如图1方法脱除
 ,并制得
,并制得 .
. ①在阴极放电的物质是
②在阳极生成
 的电极反应式是
的电极反应式是 ③已知室温下,
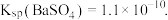 将脱除
将脱除 后制得的
后制得的 配成
配成 的
的 溶液,与
溶液,与 的
的  溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的  ,则
,则  溶液与
溶液与  溶液的体积比为
溶液的体积比为  欲使溶液中
欲使溶液中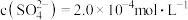 ,则应保持溶液中
,则应保持溶液中 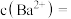
 .
. (4)一定条件下,用
 、NiO或
、NiO或 作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
作催化剂,利用如下反应回收燃煤烟气中的硫.反应为: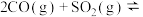
 其他条件相同、催化剂不同时,
其他条件相同、催化剂不同时, 的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择
的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择  选填序号
选填序号 ;
;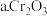
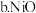
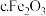
选择该催化剂的理由是:
某科研小组用选择的催化剂,在
 时,研究了
时,研究了 :
: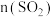 分别为1:1、3:1时,
分别为1:1、3:1时, 转化率的变化情况
转化率的变化情况 图
图 则图3中表示
则图3中表示 :
: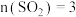 :1的变化曲线为
:1的变化曲线为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】Bi2S3(硫化铋)在光催化剂、锂离子电池等领域具有重要潜在价值,一种由辉铋矿(主要成分为Bi2S3,含SiO2、Cu2S等杂质)为原料提纯制备Bi2S3的工艺流程如图所示:

已知:①25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
②在本工艺条件下,还原性顺序为Fe>Cu>Bi。
(1)滤液1中含有FeCl3、FeCl2、CuCl2和BiCl3,滤渣1的成分是S和______ ,加入盐酸保持溶液pH<1.4,否则铋元素以碱式氯化铋(BiOCl)的形式混入滤渣1使产率降低,生成BiOCl的离子方程式为________ 。
(2)“还原”步骤中加入金属单质Bi的目的是________ 且不引入新杂质。
(3)“碱溶”步骤中加入NH3•H2O的目的是将Cu(OH)2转化为可溶性的______ (填离子符号)。
(4)“转化”步骤中硫代乙酰胺(CH3CSNH2)在酸性溶液中会水解为乙酰胺(CH3CONH2)和硫化氢;硫化氢会进一步发生反应:2Bi3+(aq)+3H2S Bi2S3(s)+6H+(aq) K,则Ksp(Bi2S3)=
Bi2S3(s)+6H+(aq) K,则Ksp(Bi2S3)=______ (用含K,H2S的Ka1、Ka2的式子表示)。
(5)若取10kg铋含量为85%的辉铋矿,经上述流程(铋元素在整个流程中损失率为5%),计算最终可制得Bi2S3固体的质量约为9.9kg,实测干燥的Bi2S3产量高于计算值的原因是________ 。
(6)新型二维半导体芯片材料——硒氧化铋晶胞结构如图所示,该晶体的化学式为________ 。


已知:①25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Bi3+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 7.5 | 2.2 | 4.5 | 5.2 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 9.0 | 3.2 | 5.5 | 6.7 |
(1)滤液1中含有FeCl3、FeCl2、CuCl2和BiCl3,滤渣1的成分是S和
(2)“还原”步骤中加入金属单质Bi的目的是
(3)“碱溶”步骤中加入NH3•H2O的目的是将Cu(OH)2转化为可溶性的
(4)“转化”步骤中硫代乙酰胺(CH3CSNH2)在酸性溶液中会水解为乙酰胺(CH3CONH2)和硫化氢;硫化氢会进一步发生反应:2Bi3+(aq)+3H2S
 Bi2S3(s)+6H+(aq) K,则Ksp(Bi2S3)=
Bi2S3(s)+6H+(aq) K,则Ksp(Bi2S3)=(5)若取10kg铋含量为85%的辉铋矿,经上述流程(铋元素在整个流程中损失率为5%),计算最终可制得Bi2S3固体的质量约为9.9kg,实测干燥的Bi2S3产量高于计算值的原因是
(6)新型二维半导体芯片材料——硒氧化铋晶胞结构如图所示,该晶体的化学式为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
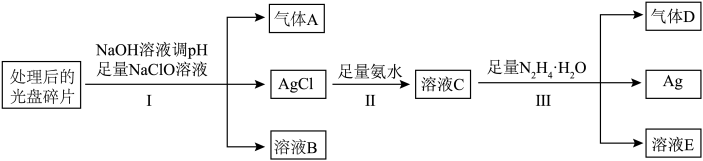
【推荐3】光盘金属层含有Ag(其它金属微量忽略不计),可以进行资源回收利用,下图为从光盘中提取Ag的工业流程。
②配离子的形成是分步进行的: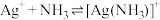
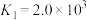 ;
;
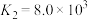 。
。
③AgCl的Ksp=1.8×10-10 。
请回答:
(1)已知Ag位于周期表的第五周期IB族,Ag的原子序数为___________ 。
(2)写出反应Ⅰ的离子方程式___________ ,从反应产物的角度分析,以HNO3代替NaClO的缺点是___________ 。
(3)水合肼是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述流程中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有___________ (写出一条即可)。
(4)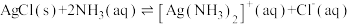 是一个可逆反应。
是一个可逆反应。
①结合相关数据说明上述反应是可逆反应___________ ;
②设计实验验证上述反应是可逆反应___________ 。
②配离子的形成是分步进行的:
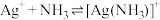
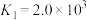 ;
;
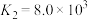 。
。③AgCl的Ksp=1.8×10-10 。
请回答:
(1)已知Ag位于周期表的第五周期IB族,Ag的原子序数为
(2)写出反应Ⅰ的离子方程式
(3)水合肼是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述流程中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有
(4)
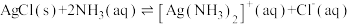 是一个可逆反应。
是一个可逆反应。①结合相关数据说明上述反应是可逆反应
②设计实验验证上述反应是可逆反应
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】H、N、P、Cl、Mg、Al、Cu元素的单质及其化合物在生活、工业和国防领域应用广泛。请回答下列问题:
(1)基态氯原子核外电子占据最高能级的电子云轮廓图为____ 形,Ag与Cu位于同一族且相邻,基态银原子的价电子排布式为____ ,Cu、Ag元素位于元素周期表____ 区。
(2)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为426℃,能升华,熔化呈液态时不导电。CuF的熔点比CuCl的高,原因是____ 。
(3)镁合金是航空器、航天器和火箭导弹制造工业中使用的最轻金属结构材料。以氨水和磷酸一氢铵[(NH4)2HPO4]检验Mg2+的反应中,有白色晶体MgNH4PO4·6H2O沉淀生成。N、P、Mg中第一电离能由大到小的顺序为____ (用元素符号表示),分子中N原子的杂化类型为____ ,PO 的空间构型为
的空间构型为____ 。
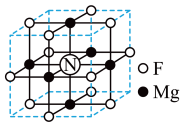
(4)一种由Mg2+、N3-、F-组成的化合物的立方晶胞如图所示。该化合物的化学式为____ ,若距离最近的两个Mg2+的核间距为apm,NA表示阿伏加德罗常数的值,则晶胞密度为____ g·cm-3。
(1)基态氯原子核外电子占据最高能级的电子云轮廓图为
(2)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为426℃,能升华,熔化呈液态时不导电。CuF的熔点比CuCl的高,原因是
(3)镁合金是航空器、航天器和火箭导弹制造工业中使用的最轻金属结构材料。以氨水和磷酸一氢铵[(NH4)2HPO4]检验Mg2+的反应中,有白色晶体MgNH4PO4·6H2O沉淀生成。N、P、Mg中第一电离能由大到小的顺序为
 的空间构型为
的空间构型为(4)一种由Mg2+、N3-、F-组成的化合物的立方晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___ 。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。

如图可知,Li原子的第一电离能为___ kJ·mol-1,O=O键键能为___ kJ·mol-1,Li2O晶格能为__ kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(4)NH4H2PO4中,P的杂化轨道类型为___ 。
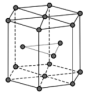
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___ 。六棱柱底边边长为a cm,高为ccm,阿伏加 德罗常数的值为NA,Zn的密度为___ g·cm-3(列出计算式即可)。
(1)Fe基态原子核外电子排布式为
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。

如图可知,Li原子的第一电离能为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(4)NH4H2PO4中,P的杂化轨道类型为
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】铁氨化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy,的制备需铁、氨气丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为_______ 。
(2)丙酮(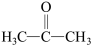 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是_______ ,三种元素电负性由小到大的顺序为_______ ,1mol丙酮分子中含有σ键的数目为_______ 。
(3)N、P、S三种元素的第一电离能由小到大的顺序为_______ 。
(4)乙醇(CH3CH2OH)的沸点高于丙酮,这是因为_______ 。
(5)磷酸根离子的空间构型为_______ 。
(1)Fe3+基态核外电子排布式为
(2)丙酮(
 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)N、P、S三种元素的第一电离能由小到大的顺序为
(4)乙醇(CH3CH2OH)的沸点高于丙酮,这是因为
(5)磷酸根离子的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】黄铜矿(主要成分为 )可用于冶炼
)可用于冶炼 ,主要物质转化过程如下:
,主要物质转化过程如下:
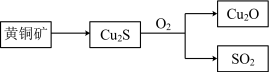
(1) 与
与 共热制备
共热制备 的反应中,每生成1mol
的反应中,每生成1mol 转移的电子数为
转移的电子数为______ 。
(2)为减少 对环境的污染,在高温时可以用CaO将其转化为
对环境的污染,在高温时可以用CaO将其转化为 ,反应的化学方程式为
,反应的化学方程式为______ 。
(3) 中心原子的杂化方式是
中心原子的杂化方式是______ ,用价层电子对互斥理论解释 的空间结构不同于
的空间结构不同于 的原因:
的原因:______ 。
(4)如图中,表示 晶胞的是
晶胞的是______ (填“图1”或“图2”)。

(5) 与
与 都可视为离子晶体,且结构相似,但
都可视为离子晶体,且结构相似,但 的熔点比
的熔点比 的高约100℃,原因是
的高约100℃,原因是______ 。
(6) 的晶胞如图3所示。
的晶胞如图3所示。
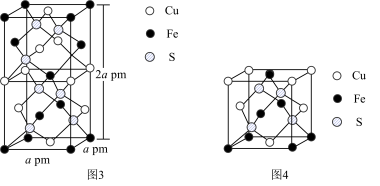
①图4所示结构单元不能 作为 晶胞的原因是
晶胞的原因是______ 。
②从图3可以看出,每个 晶胞中含有的Cu原子个数为
晶胞中含有的Cu原子个数为______ .
③已知: 晶体的密度是
晶体的密度是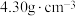 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 .
. 晶胞中底边边长
晶胞中底边边长
______ pm(用计算式表示; 的摩尔质量为
的摩尔质量为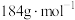 )。
)。
 )可用于冶炼
)可用于冶炼 ,主要物质转化过程如下:
,主要物质转化过程如下:
(1)
 与
与 共热制备
共热制备 的反应中,每生成1mol
的反应中,每生成1mol 转移的电子数为
转移的电子数为(2)为减少
 对环境的污染,在高温时可以用CaO将其转化为
对环境的污染,在高温时可以用CaO将其转化为 ,反应的化学方程式为
,反应的化学方程式为(3)
 中心原子的杂化方式是
中心原子的杂化方式是 的空间结构不同于
的空间结构不同于 的原因:
的原因:(4)如图中,表示
 晶胞的是
晶胞的是
(5)
 与
与 都可视为离子晶体,且结构相似,但
都可视为离子晶体,且结构相似,但 的熔点比
的熔点比 的高约100℃,原因是
的高约100℃,原因是(6)
 的晶胞如图3所示。
的晶胞如图3所示。
①图4所示结构单元
 晶胞的原因是
晶胞的原因是②从图3可以看出,每个
 晶胞中含有的Cu原子个数为
晶胞中含有的Cu原子个数为③已知:
 晶体的密度是
晶体的密度是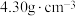 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 .
. 晶胞中底边边长
晶胞中底边边长
 的摩尔质量为
的摩尔质量为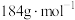 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________ 。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______ (填写序号)。
a.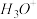 b.
b. 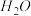 c.
c. 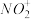 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有_________ 个π键。
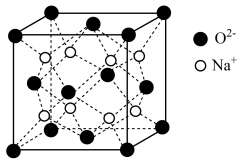
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________ 。已知该晶胞的密度为ρg/cm3,阿伏伽德罗常数为NA,求晶胞边长
_______ cm。(用含ρ、NA的代数式表示)
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是
a.
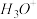 b.
b. 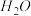 c.
c. 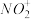 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为


您最近一年使用:0次
【推荐3】钠、镁、铝、铜及其化合物在生活中具有重要作用。回答下列问题:
(1)基态Cu+的价层轨道表示式为___________ 。
(2)Na、Mg、Al的第一电离能由大到小的顺序为___________ (填元素符号)。
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:
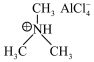
该化合物中阴离子的空间构型为___________ ;传统的有机溶剂大多易挥发,而离子液体相对难挥发,原因是___________ 。
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
离子键成分的百分数:MgO高于Al2O3,其原因是___________ ;熔点:MgO高于Na2O,从结构的角度解释其原因是___________ 。
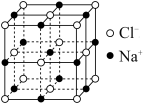
(5)NaCl的晶胞如图所示。NaCl的密度为ρ g/cm3,在NaCl晶体里Na+和Cl-的最短距离为apm,则阿伏加德罗常数的值为___________ (用含a、ρ的表达式表示)。
(1)基态Cu+的价层轨道表示式为
(2)Na、Mg、Al的第一电离能由大到小的顺序为
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:

该化合物中阴离子的空间构型为
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
| 氧化物 | Na2O | MgO | Al2O3 |
| 离子键的百分数/% | 62 | 50 | 41 |
| 熔点/℃ | 1132 | 2852 | 2054 |
(5)NaCl的晶胞如图所示。NaCl的密度为ρ g/cm3,在NaCl晶体里Na+和Cl-的最短距离为apm,则阿伏加德罗常数的值为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】硒(Se)是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含Se分子(Ⅳ)合成路线如下:
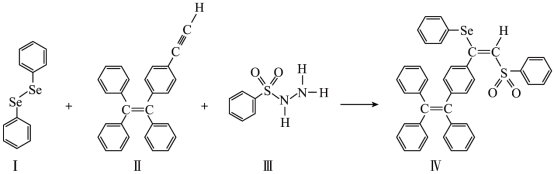
(1)Se与S同族,基态硒原子价电子排布式为__________ 。
(2) 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:__________ 。
(3)关于Ⅰ~Ⅳ四种物质中,下列说法正确的有__________ 。
a.Ⅰ中仅有 键,其中的Se—Se键为非极性键
键,其中的Se—Se键为非极性键
b.Ⅱ易溶于水,其分子式为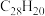
c.Ⅲ、Ⅳ中C均为 杂化,S均为
杂化,S均为 杂化
杂化
d.Ⅰ~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有__________ 。
(5)推测硒的两种含氧酸的酸性强弱为
______  (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠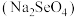 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为__________ 。
(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
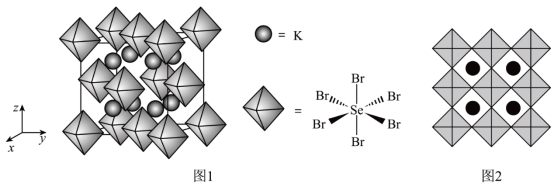
①X的化学式为__________ 。
②设X的最简式的式量为Mr,晶体密度为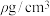 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为__________ nm(列出计算式, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,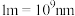 )。
)。

(1)Se与S同族,基态硒原子价电子排布式为
(2)
 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:(3)关于Ⅰ~Ⅳ四种物质中,下列说法正确的有
a.Ⅰ中仅有
 键,其中的Se—Se键为非极性键
键,其中的Se—Se键为非极性键b.Ⅱ易溶于水,其分子式为
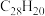
c.Ⅲ、Ⅳ中C均为
 杂化,S均为
杂化,S均为 杂化
杂化d.Ⅰ~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)推测硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠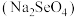 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为Mr,晶体密度为
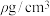 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,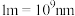 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液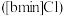 可以与
可以与 混合形成离子液体;
混合形成离子液体;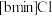 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是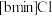 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体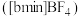 的流程:
的流程:

某种 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在 构成的八面体体心)。
构成的八面体体心)。

①该晶胞中 的配位数为
的配位数为___________ 。
②该晶胞有___________  (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。
③已知氧离子半径为 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液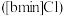 可以与
可以与 混合形成离子液体;
混合形成离子液体;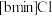 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是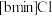 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体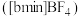 的流程:
的流程:
某种
 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在 构成的八面体体心)。
构成的八面体体心)。
①该晶胞中
 的配位数为
的配位数为②该晶胞有
 (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。③已知氧离子半径为
 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
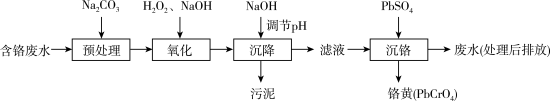
【推荐3】含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是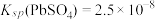 ;
;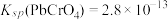 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
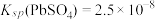 ;
;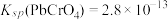 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
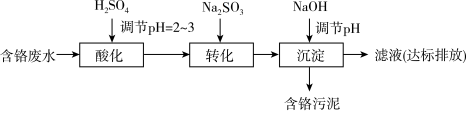
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近一年使用:0次



