名校
解题方法
1 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
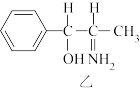
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)比较NH3分子(前者)和在 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者___________ 后者。(填“>”、“<”或“=”)
(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。

(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)比较NH3分子(前者)和在
 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-09-13更新
|
270次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三10月月考化学试题
名校
解题方法
2 . N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为_____ (填字母)。
(2)NF3是一种优良的等离子蚀刻气体,在芯片制造、高能激光器领域有广泛应用,NF3是_____ (填“极性”或“非极性”)分子。
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:_____ 。
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为______ 。该储氢材料储氢时,氢分子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为_____ 。

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是_____ 。若晶胞的密度为dg•cm-3,则Cu原子与Br原子之间的最短距离为____ (列出计算式即可,NA表示阿伏加德罗常数的值)。

(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为
A.1s22s22p 2p 2p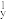 2p 2p | B.1s22s22p 2p 2p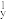 3s1 3s1 |
C.1s22s22p 2p 2p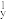 | D.1s22s22p 3s1 3s1 |
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是

您最近一年使用:0次
2022-12-16更新
|
139次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题
3 . I.根据等电子体原理可知:
(1)仅由第二周期元素组成的共价分子中互为等电子体的有____ 组。
(2)试预测N 的空间构型为
的空间构型为____ 。
II.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应(见图)可以制得Ti3N4和纳米TiO2。

图中的M是短周期金属元素,M的部分电离能如表:
(3)M是____ (填元素符号),该金属晶体的堆积模型为____ ,配位数为____ 。
(4)基态Ti3+中未成对电子数有____ 个;与Ti同族相邻的元素Zr的基态原子外围电子排布式为____ ;钛元素最高化合价为____ 。
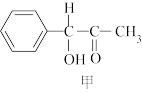
(5)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子数为____ ,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为____ 。

(6)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为apm,则该氮化钛的密度为____ g•cm-3(NA为阿伏加德罗常数的值,只列计算式)。
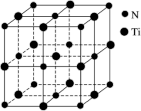
该晶体中与N原子距离相等且最近的N原子有____ 个。
科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如表:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为____ 。
(1)仅由第二周期元素组成的共价分子中互为等电子体的有
(2)试预测N
 的空间构型为
的空间构型为II.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应(见图)可以制得Ti3N4和纳米TiO2。

图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(4)基态Ti3+中未成对电子数有
(5)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子数为



(6)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为apm,则该氮化钛的密度为

该晶体中与N原子距离相等且最近的N原子有
科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
名校
4 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的电子排布式为[Ar]___________ ,Ti原子核外有___________ 种空间运动状态不同的电子。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由大到小的顺序为___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为___________ 。
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③乙二胺形成配合物后,H-N-H键角将变大,原因是___________ 。
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为___________ pm(列出计算式)。

(1)基态Ti原子的电子排布式为[Ar]
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③乙二胺形成配合物后,H-N-H键角将变大,原因是
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为

您最近一年使用:0次
2022-03-10更新
|
230次组卷
|
2卷引用:甘肃省张掖市民乐县第一中学2023-2024学年高三上学期第二次诊断(期中)考试化学试题



