1 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④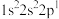 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④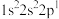 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近一年使用:0次
2024-01-24更新
|
141次组卷
|
7卷引用:山东省2019-2020学年高二下学期第二次联合考试化学试题
名校
2 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
147次组卷
|
5卷引用:四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题
名校
解题方法
3 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近一年使用:0次
2023-07-29更新
|
99次组卷
|
6卷引用:【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题
【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
20-21高二下·吉林延边·阶段练习
名校
解题方法
4 . 部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是


| A.离子半径的大小顺序:e>f>g>h |
| B.g、h的氧化物对应水化物的酸性:h>g |
| C.y、z、d三种元素第一电离能和电负性的大小顺序不一致 |
| D.e、f两种元素对应最高价氧化物的水化物之间不能发生反应 |
您最近一年使用:0次
2021-08-24更新
|
448次组卷
|
4卷引用:2020年天津卷化学高考真题变式题1-12
(已下线)2020年天津卷化学高考真题变式题1-12吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题2021年天津高考化学试题变式题1-12(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
5 . 三氟化氮(NF3)常温下是一种无色无味的气体,它由氨气(NH3)和氟气(F2)在一定条件下直接反应制得: 4NH3 + 3F2=NF3 + 3NH4F。下列说法正确的是
| A.N、H、F元素的电负性大小为: N > F > H |
| B.NH3和NF3分子中形成的共价键类型中有π键 |
| C.NF3中的N呈+3价 |
| D.NH4F中的化学键类型有离子键、极性共价键、配位键 |
您最近一年使用:0次
6 . 现有两种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
您最近一年使用:0次
2021-01-29更新
|
206次组卷
|
3卷引用:江苏省木渎高级中学等三校2020-2021学年高二上学期12月联合调研化学试题
名校
7 . 非线性光学晶体在信息、激光技术、医疗、国防等领域有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为___________ ;第一电离能 I1(Si)___________ I1(Ge)(填>或<)。
(2)基态Ge原子核外电子排布式为___________ ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是___________ ,原因是___________ 。
(3)图中为硼酸晶体的片层结构,其中硼的杂化方式为___________ 。H3BO3在热水中比冷水中溶解度显著增大的主要原因是___________
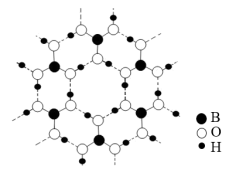
(1)C、O、Si三种元素电负性由大到小的顺序为
(2)基态Ge原子核外电子排布式为
(3)图中为硼酸晶体的片层结构,其中硼的杂化方式为

您最近一年使用:0次
名校
解题方法
8 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为_ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___ 。
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是__ ;金属离子与氧离子间的作用力为__ ,Ca2+的配位数是__ 。
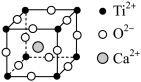
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |

您最近一年使用:0次
解题方法
9 . 已知铜的配合物A(结构如下图)。请回答下列问题:Cu

(1)Cu2+基态核外电子排布式为___________ 。基态Cu原子中,核外电子占据最高能层的符号是___________ 。
(2)A所含三种元素C、N、O的电负性大小顺序为___________ 。其中氮原子的杂化轨道类型为___________ 。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ 分子(极性或非极性); N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为___________ 。
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是_______
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角___________ 120°(选填“大于”、“等于”或“小于”),甲醛能与水形成氢键,其表示式为:___________ 。

(1)Cu2+基态核外电子排布式为
(2)A所含三种元素C、N、O的电负性大小顺序为
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角
您最近一年使用:0次
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,元素Y是地壳中含量最多的元素,X与Z同主族且二者可形成离子化合物,W的最外层电子数是其电子层数的2倍。下列说法正确的是
| A.电负性:X<W<Y | B.第一电离能:Z<W<Y |
| C.元素W的含氧酸均为强酸 | D.Z的氧化物对应的水化物为弱碱 |
您最近一年使用:0次



