名校
1 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________ 位。
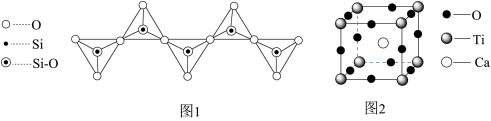
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________ ,Si原子的杂化类型为__________________ 。
3.N元素位于元素周期表_____________ 区;基态N原子中,核外电子占据最高能级的电子云有____ 个伸展方向。
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________ 个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________ 种不同的结构形式。
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________ 个。
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=__________________ g· cm-3(用含α、NA的代数式表示)。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为
3.N元素位于元素周期表
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=
您最近一年使用:0次
2018-01-08更新
|
379次组卷
|
2卷引用:江苏省溧水高级中学2017-2018学年高二下学期期末考试(选修)化学试题
名校
解题方法
2 . 2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的外围电子排布式是_______________ 。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________ ,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________ 。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______ ,与同一个镓原子相连的砷原子构成的立体构型为___________ ,镓采取的杂化方式为________________ 。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________ ,其结构式为_____________ ,硼酸是_______ 元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________ cm,NA表示阿伏伽德罗常数,则该晶体的密度为________ g/cm3。

(1)镓的基态原子的外围电子排布式是
(2)镓与钾、钙元素的第一电离能从大到小依次为
(3)此晶胞中所含的砷原子(白色球)个数为
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为
您最近一年使用:0次
解题方法
3 . Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________ 。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________ 。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________ ,从原子结构的角度解释不存在RCl5分子的原因_______ 。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________ 。
②甲→乙的化学方程式为______________ 。
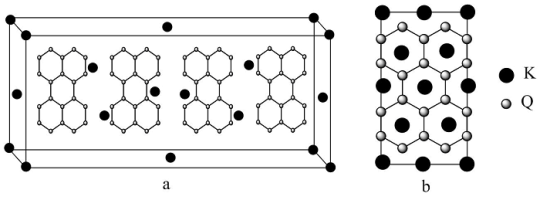
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________ 。
(1)Z原子的价电子排布式为
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为
②甲→乙的化学方程式为
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为

您最近一年使用:0次



