名校
1 . A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
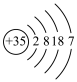
(1)写出元素A的原子结构示意图___________ 。
(2)A、B最高价氧化物对应水化物的碱性强弱:___________ >___________ (填化学式),从原子结构角度解释原因___________ 。
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式________________ 。
(4)用电子式表示C和D形成化合物的过程:_______________ 。
(5)元素E在周期表中的位置___________ ,关于元素E及其化合物的推断中,正确的是___________ 。
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)___________ ,原因是________________ 。
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为___________ ,任意写出一个能体现②的类别通性的反应方程式_____________ 。
(8)第四周期ⅥA族的元素硒 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)___________ 。
a.硒原子的半径比硫原子的大 b. 的稳定性比HCl的强
的稳定性比HCl的强
c. 能与NaOH溶液反应 d.
能与NaOH溶液反应 d.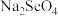 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
| 元素 | 元素性质/原子结构信息 |
| A | 短周期元素原子半径最大(稀有气体不参与比较) |
| B | +3价阳离子的核外电子排布与氖原子相同 |
| C | 原子核外M电子层与K电子层的电子数相等 |
| D | 与A同周期,化合价有-1、+7等 |
| E | 原子结构示意图: |
(1)写出元素A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱:
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示C和D形成化合物的过程:
(5)元素E在周期表中的位置
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为
(8)第四周期ⅥA族的元素硒
 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)a.硒原子的半径比硫原子的大 b.
 的稳定性比HCl的强
的稳定性比HCl的强c.
 能与NaOH溶液反应 d.
能与NaOH溶液反应 d.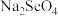 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
您最近一年使用:0次
名校
解题方法
2 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④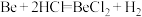 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用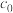 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸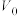 mL(已知:
mL(已知: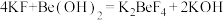 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含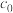 、
、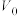 和
和 的字母表示)。
的字母表示)。
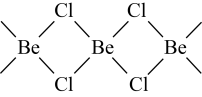
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
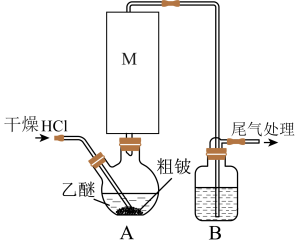
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
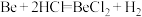 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸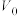 mL(已知:
mL(已知: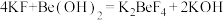 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为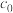 、
、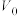 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
名校
解题方法
3 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: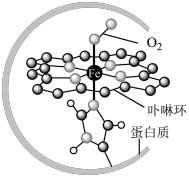
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
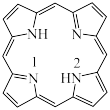
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。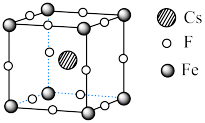
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-11更新
|
324次组卷
|
3卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题天津市耀华中学2024届高三下学期第二次模拟化学试题
4 . 氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)298K时,1g 燃烧生成
燃烧生成 放热120.9kJ,1mol
放热120.9kJ,1mol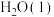 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为______ 。
(2)碱性(电解质为KOH溶液)氢氧燃料电池中负极电极反应式为______ 。
(3)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.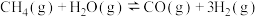
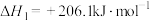
Ⅱ.
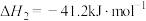
①下列措施中,不能提高 平衡转化率的是
平衡转化率的是______ (填标号)。
A.增加 用量 B.增加
用量 B.增加 用量
用量
C.恒温恒压下通入惰性气体 D.加入催化剂
②恒温恒压条件下,1mol 和1mol
和1mol 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为b mol。其他条件不变,
的物质的量为b mol。其他条件不变, 起始量增加到4mol,达平衡时,
起始量增加到4mol,达平衡时,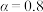 ,
,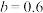 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为______ (结果保留3位有效数字,下同),该条件下,反应Ⅱ的化学平衡常数
______ 。
③“碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应为:
是实现“双碳”经济的有效途径之一,相关的主要反应为: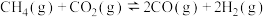
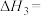
______ 。
(4)氢气还是合成氨工业的原料气,其反应为:
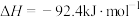
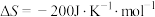 。该反应在常温下
。该反应在常温下______ (填“能”或“不能”)自发。
(1)298K时,1g
 燃烧生成
燃烧生成 放热120.9kJ,1mol
放热120.9kJ,1mol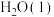 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)碱性(电解质为KOH溶液)氢氧燃料电池中负极电极反应式为
(3)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
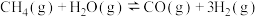
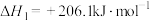
Ⅱ.

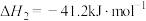
①下列措施中,不能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量 B.增加
用量 B.增加 用量
用量C.恒温恒压下通入惰性气体 D.加入催化剂
②恒温恒压条件下,1mol
 和1mol
和1mol 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为b mol。其他条件不变,
的物质的量为b mol。其他条件不变, 起始量增加到4mol,达平衡时,
起始量增加到4mol,达平衡时,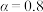 ,
,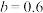 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为
③“碳达峰·碳中和”是我国社会发展重大战略之一,
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应为:
是实现“双碳”经济的有效途径之一,相关的主要反应为: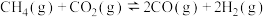
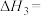
(4)氢气还是合成氨工业的原料气,其反应为:

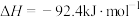
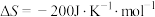 。该反应在常温下
。该反应在常温下
您最近一年使用:0次
名校
解题方法
5 . 氯代环己烷为无色液体,具有窒息性气味,不溶于水,溶于乙醇,可生产农药、橡胶b防焦剂、医药等。请回答下列问题:
Ⅰ.制备氯代环已烷有两种方法:________ 。
(2) 是环已烯的同分异构体,其名称为
是环已烯的同分异构体,其名称为________ 。
Ⅱ.现用如图所示装置模拟方法②制备氯代环已烷,具体操作步骤如下:在250mL三口烧瓶中加入35mL(0.35mol)环已烯,3g催化剂,搅拌升温,打开仪器a的活塞向三口烧瓶中加入100mL30%(约0.95mol)的盐酸,调节反应温度为75℃,搅拌反应1.5小时,待反应结束,冷却静置。分别使用饱和氯化钠溶液和碳酸钠溶液洗涤有机层3次,再向有机层中加入适量无水硫酸镁后蒸馏,得产品31g。________ 。
(4)该实验中合适的加热方式是________ 。
(5)使用碳酸钠溶液洗涤有机层的目的是:________ 。
(6)加入适量无水硫酸镁的目的是:________ 。
(7)该实验氯代环已烷的产率为________ 。(结果保留三位有效数字)
Ⅰ.制备氯代环已烷有两种方法:
①环己烷氯化法:
②环己烯氯化氢加成法:
(2)
 是环已烯的同分异构体,其名称为
是环已烯的同分异构体,其名称为Ⅱ.现用如图所示装置模拟方法②制备氯代环已烷,具体操作步骤如下:在250mL三口烧瓶中加入35mL(0.35mol)环已烯,3g催化剂,搅拌升温,打开仪器a的活塞向三口烧瓶中加入100mL30%(约0.95mol)的盐酸,调节反应温度为75℃,搅拌反应1.5小时,待反应结束,冷却静置。分别使用饱和氯化钠溶液和碳酸钠溶液洗涤有机层3次,再向有机层中加入适量无水硫酸镁后蒸馏,得产品31g。

(4)该实验中合适的加热方式是
(5)使用碳酸钠溶液洗涤有机层的目的是:
(6)加入适量无水硫酸镁的目的是:
(7)该实验氯代环已烷的产率为
您最近一年使用:0次
2024-05-07更新
|
173次组卷
|
3卷引用:期末押题卷02 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
(已下线)期末押题卷02 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)湖北省云学名校联盟2023-2024学年高二下学期期中联考化学试卷B湖北省云学名校联盟2023-2024学年高二下学期期中联考化学试卷(A)
6 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.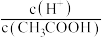 C.
C.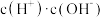 D.
D. E.
E. 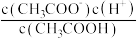
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
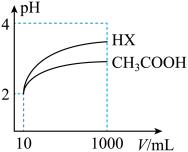
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
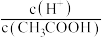 C.
C.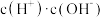 D.
D. E.
E. 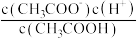
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
解题方法
7 . 甲烷干重整(DRM)是利用 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
Ⅰ.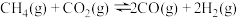
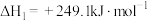
Ⅱ.
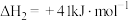
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知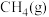 、
、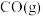 的摩尔生成焓分别为
的摩尔生成焓分别为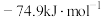 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为_______  。
。
(2)甲烷和二氧化碳的起始物质的量均为 ,实验测得在
,实验测得在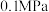 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。_______ mol,反应Ⅱ的压强平衡常数
_______ 。
②为了消除积碳带来的影响,反应选择在_______ (填“高温”或“低温”)下进行。
(3)在不同压强下,按照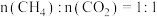 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为________ 。
②压强 、
、 、
、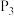 、
、 由小到大的顺序为
由小到大的顺序为________ 。
③ ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是________ 。
 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:Ⅰ.
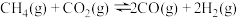
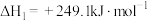
Ⅱ.

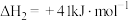
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成
 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知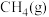 、
、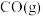 的摩尔生成焓分别为
的摩尔生成焓分别为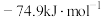 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为 。
。(2)甲烷和二氧化碳的起始物质的量均为
 ,实验测得在
,实验测得在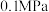 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。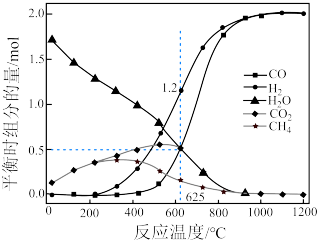

②为了消除积碳带来的影响,反应选择在
(3)在不同压强下,按照
 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。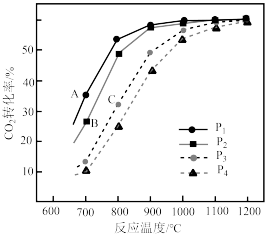
 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为②压强
 、
、 、
、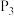 、
、 由小到大的顺序为
由小到大的顺序为③
 ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是
您最近一年使用:0次
解题方法
8 . 二氧化碲(TeO2)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为Cu2Te,还含有少量Cu,Ag)为原料制备TeO2并获得海绵铜的工艺流程如图所示。
(1)Te位于元素周期表的___________ 族。
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为___________ ,为了加快反应速率,不可以采取的措施为___________ (写字母)
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:______ 。
□Ag+□H++□ =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。
③若使用稀硝酸代替NaClO3,不足之处可能是___________ 。
(3)“碱浸提碲”时,TeO2反应的化学方程式为___________ ,浸渣b的主要成分为___________ 。
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为___________ 。
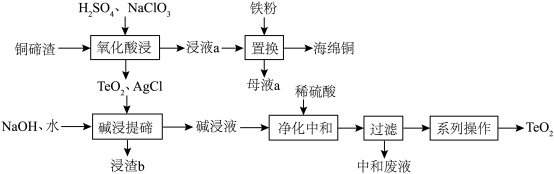
(1)Te位于元素周期表的
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:
□Ag+□H++□
 =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。③若使用稀硝酸代替NaClO3,不足之处可能是
(3)“碱浸提碲”时,TeO2反应的化学方程式为
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为
您最近一年使用:0次
名校
9 . 柠檬酸是一种重要的工业原料,化学式可表示为 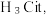 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 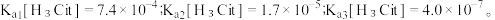
(1)25℃时, 不同pH范围内,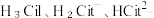 和
和 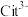 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是_______ 。
(3)已知25℃时,碳酸的电离常数为: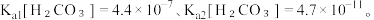 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式_______ 。
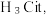 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 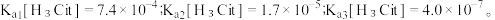
(1)25℃时, 不同pH范围内,
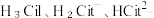 和
和 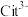 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是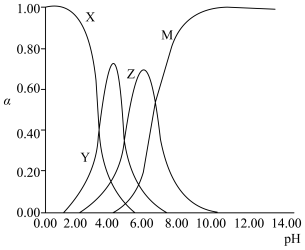
A.Na3Cit溶液中, |
B.Na3Cit溶液中,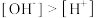 |
C.NaH2Cit溶液中, |
D.Na2HCit溶液中,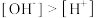 |
(3)已知25℃时,碳酸的电离常数为:
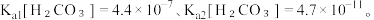 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
您最近一年使用:0次
10 . 硫脲(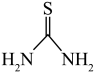 )可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取
)可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取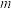 g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用
g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用 酸性
酸性 标准溶液滴定,滴定至终点时消耗标准溶液
标准溶液滴定,滴定至终点时消耗标准溶液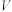 mL[已知滴定时发生反应:
mL[已知滴定时发生反应: ,假设杂质不参与反应]。下列叙述正确的是
,假设杂质不参与反应]。下列叙述正确的是
| A.硫脲中硫元素的化合价为+2 |
| B.滴定时碳、氮元素发生氧化反应 |
C.样品中硫脲的质量分数可表示为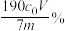 |
| D.若滴定管中滴定前有气泡,滴定后无气泡,会使测定结果偏小 |
您最近一年使用:0次