真题
1 .  气氛下,
气氛下,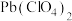 溶液中含铅物种的分布如图。纵坐标(
溶液中含铅物种的分布如图。纵坐标( )为组分中铅占总铅的质量分数。已知
)为组分中铅占总铅的质量分数。已知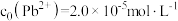 ,
,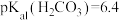 、
、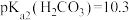 ,
,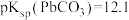 。下列说法错误的是
。下列说法错误的是
 气氛下,
气氛下,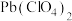 溶液中含铅物种的分布如图。纵坐标(
溶液中含铅物种的分布如图。纵坐标( )为组分中铅占总铅的质量分数。已知
)为组分中铅占总铅的质量分数。已知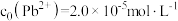 ,
,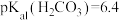 、
、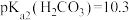 ,
,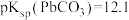 。下列说法错误的是
。下列说法错误的是
A. 时,溶液中 时,溶液中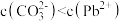 |
B.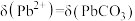 时, 时,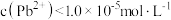 |
C.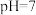 时, 时,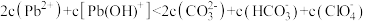 |
D. 时,溶液中加入少量 时,溶液中加入少量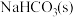 , ,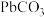 会溶解 会溶解 |
您最近一年使用:0次
2 . 钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。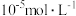 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。
已知:①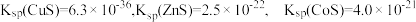 。
。
②以氢氧化物形式沉淀时,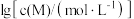 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是_____ 。
(2)“酸浸”步骤中, 发生反应的化学方程式是
发生反应的化学方程式是_____ 。
(3)假设“沉铜”后得到的滤液中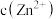 和
和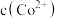 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中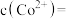
_____  ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离_____ (填“能”或“不能”)。
(4)“沉锰”步骤中,生成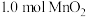 ,产生
,产生 的物质的量为
的物质的量为_____ 。
(5)“沉淀”步骤中,用 调
调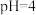 ,分离出的滤渣是
,分离出的滤渣是_____ 。
(6)“沉钴”步骤中,控制溶液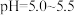 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____ 。
 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
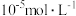 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。已知:①
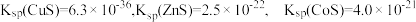 。
。②以氢氧化物形式沉淀时,
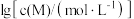 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是
(2)“酸浸”步骤中,
 发生反应的化学方程式是
发生反应的化学方程式是(3)假设“沉铜”后得到的滤液中
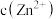 和
和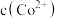 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中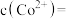
 ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离(4)“沉锰”步骤中,生成
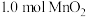 ,产生
,产生 的物质的量为
的物质的量为(5)“沉淀”步骤中,用
 调
调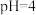 ,分离出的滤渣是
,分离出的滤渣是(6)“沉钴”步骤中,控制溶液
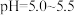 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是
您最近一年使用:0次
真题
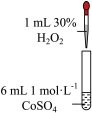
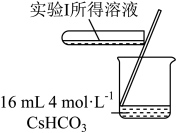
3 . 将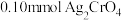 配制成
配制成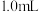 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
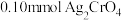 配制成
配制成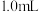 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
A.交点a处: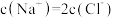 |
B.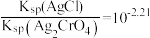 |
C.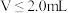 时, 时,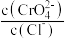 不变 不变 |
D.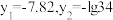 |
您最近一年使用:0次
真题
4 . 逆水气变换反应: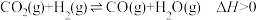 。一定压力下,按
。一定压力下,按 ,
, 物质的量之比
物质的量之比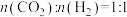 投料,
投料,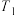 ,
,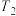 温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为
温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为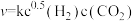 ,
,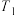 ,
,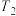 温度时反应速率常数k分别为
温度时反应速率常数k分别为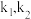 。下列说法错误的是
。下列说法错误的是
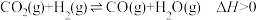 。一定压力下,按
。一定压力下,按 ,
, 物质的量之比
物质的量之比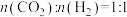 投料,
投料,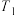 ,
,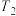 温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为
温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为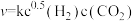 ,
,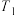 ,
,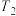 温度时反应速率常数k分别为
温度时反应速率常数k分别为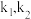 。下列说法错误的是
。下列说法错误的是
A.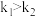 |
B.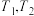 温度下达平衡时反应速率的比值: 温度下达平衡时反应速率的比值: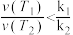 |
| C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变 |
D.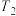 温度下,改变初始投料比例,可使平衡时各组分摩尔分数与 温度下,改变初始投料比例,可使平衡时各组分摩尔分数与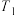 温度时相同 温度时相同 |
您最近一年使用:0次
真题
解题方法
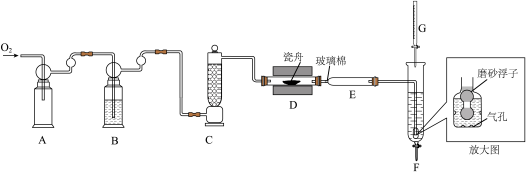
5 . 利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
①加样,将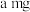 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装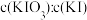 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: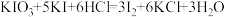 ,使溶液显浅蓝色。
,使溶液显浅蓝色。
②燃烧:按一定流速通入 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应: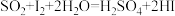 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
回答下列问题:
(1)取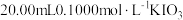 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制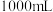
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。
(2)装置B和C的作用是充分干燥 ,B中的试剂为
,B中的试剂为_______ 。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子(见放大图),目的是_______ 。
(3)该滴定实验达终点的现象是_______ ;滴定消耗 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是_______ (用代数式表示)。
(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是_______ ;若装置E冷却气体不充分,可能导致测定结果偏大,原因是_______ ;若滴定过程中,有少量 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会_______ (填“偏大”“偏小”或“不变”)。
①加样,将
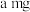 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装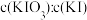 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: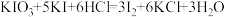 ,使溶液显浅蓝色。
,使溶液显浅蓝色。②燃烧:按一定流速通入
 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。③滴定:当F内溶液浅蓝色消退时(发生反应:
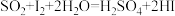 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。回答下列问题:
(1)取
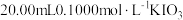 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制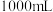
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。| A.玻璃棒 | B. 锥形瓶 锥形瓶 | C. 容量瓶 容量瓶 | D.胶头滴管 |
(2)装置B和C的作用是充分干燥
 ,B中的试剂为
,B中的试剂为(3)该滴定实验达终点的现象是
 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进
 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会
您最近一年使用:0次
真题
6 . 常温下 水溶液体系中存在反应:
水溶液体系中存在反应: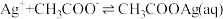 ,平衡常数为K。已初始浓度
,平衡常数为K。已初始浓度 ,所有含碳物种的摩尔分数与
,所有含碳物种的摩尔分数与 变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 水溶液体系中存在反应:
水溶液体系中存在反应: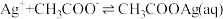 ,平衡常数为K。已初始浓度
,平衡常数为K。已初始浓度 ,所有含碳物种的摩尔分数与
,所有含碳物种的摩尔分数与 变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
变化关系如图所示(忽略溶液体积变化)。下列说法正确的是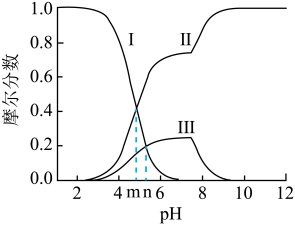
A.线Ⅱ表示 的变化情况 的变化情况 |
B. 的电离平衡常数 的电离平衡常数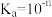 |
C. 时, 时,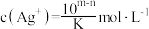 |
D.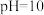 时, 时, |
您最近一年使用:0次
7 . 乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1) 氧化脱氢反应:
氧化脱氢反应:
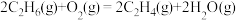
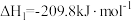
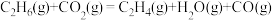
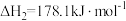
计算: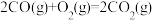

_______ 
(2) 直接脱氢反应为
直接脱氢反应为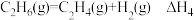 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则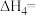
_______ 0(填“>”“<”或“=”)。结合下图。下列条件中,达到平衡时转化率最接近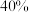 的是
的是_______ (填标号)。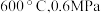 b.
b.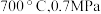 c.
c.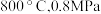
(3)一定温度和压强下、反应i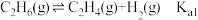
反应ⅱ (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)
①仅发生反应i时。 的平衡转化宰为
的平衡转化宰为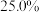 ,计算
,计算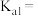
_______ 。
②同时发生反应i和ⅱ时。与仅发生反应i相比, 的平衡产率
的平衡产率_______ (填“增大”“减小”或“不变”)。
【乙烷和乙烯混合气的分离】
(4)通过 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的_______ 与 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是_______ 。
(5)常温常压下,将 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(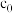 )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是_______ (填标号)。 ,两种气体均未被吸附
,两种气体均未被吸附
B.p点对应的时刻,出口气体的主要成分是
C.a-b对应的时间段内,吸附的 逐渐被
逐渐被 替代
替代
【乙烷制乙烯】
(1)
 氧化脱氢反应:
氧化脱氢反应: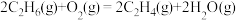
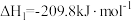
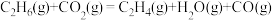
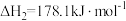
计算:
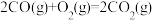


(2)
 直接脱氢反应为
直接脱氢反应为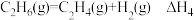 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则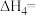
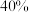 的是
的是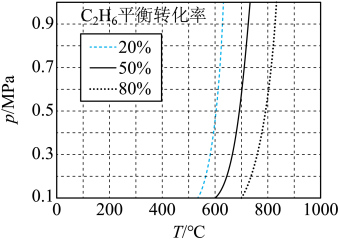
 b.
b. c.
c.
(3)一定温度和压强下、反应i
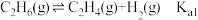
反应ⅱ
 (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)①仅发生反应i时。
 的平衡转化宰为
的平衡转化宰为 ,计算
,计算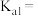
②同时发生反应i和ⅱ时。与仅发生反应i相比,
 的平衡产率
的平衡产率【乙烷和乙烯混合气的分离】
(4)通过
 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是(5)常温常压下,将
 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(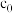 )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是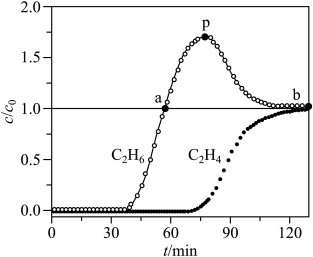
 ,两种气体均未被吸附
,两种气体均未被吸附B.p点对应的时刻,出口气体的主要成分是

C.a-b对应的时间段内,吸附的
 逐渐被
逐渐被 替代
替代
您最近一年使用:0次
真题
解题方法
8 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、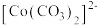 为红色、
为红色、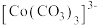 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
(1)配制 的
的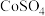 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明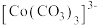 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、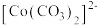 为红色、
为红色、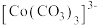 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的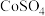 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b. 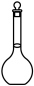 c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是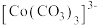 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
2025高三上·全国·专题练习
9 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
10 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在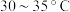 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸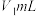 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择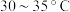 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
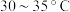 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸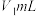 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
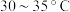 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
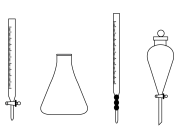
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2024-06-01更新
|
159次组卷
|
3卷引用:T15-实验综合题