名校
解题方法
1 . 乙酸苯酯是重要的药物中间体,它可以转化得到邻羟基苯乙酮和对羟基苯乙酮的混合物。一种制备乙酸苯酯的原理为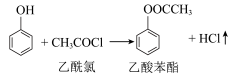 ,利用如图装置制备并提纯乙酸苯酯。
,利用如图装置制备并提纯乙酸苯酯。

已知所用试剂的部分物理性质如表所示:
| 物质 | 相对分子质量 | 部分物理性质 |
| 苯酚 | 94 | 常温下,纯净的苯酚是无色晶体,沸点为181.7℃,溶于水、乙醇,易溶于乙醚等有机溶剂 |
| 乙酰氯 | 78.5 | 常温下为无色发烟液体,沸点为52℃,溶于丙酮、乙醚等有机溶剂 |
| 乙酸苯酯 | 136 | 常温下为无色液体,沸点为195.5℃,微溶于水,可混溶于醇、氯仿、醚等有机溶剂 |
| 环己烷 | 84 | 常温下为无色有刺激性气味的液体,沸点为80.7℃,不溶于水,溶于乙醚、乙醇等有机溶剂 |
(1)仪器甲的名称为
(2)该原理制备乙酸苯酯的反应类型为
(3)其他条件相同,控制反应温度,不同温度下得到的乙酸苯酯的产率如表所示,选择表中
温度/℃ | 10 | 15 | 20 | 25 | 30 |
产率/% | 68.51 | 83.34 | 95.55 | 92.68 | 91.82 |
(4)实验结束后,进一步提纯乙酸苯酯的方法为
(5)在最佳温度下反应,最终得到乙酸苯酯的质量为
您最近一年使用:0次
昨日更新
|
52次组卷
|
3卷引用:河北省保定市部分示范性高中2023-2024学年高二下学期5月期中联考化学试题
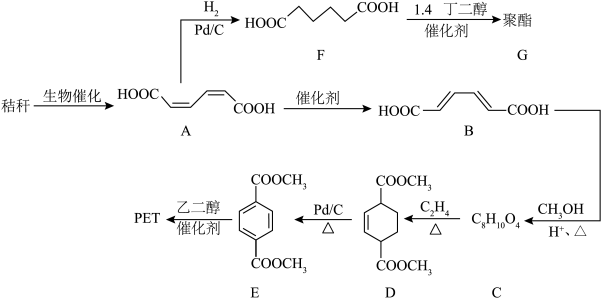
2 . 秸秆(含多糖类物质)的综合利用具有重要意义。以秸秆为原料合成聚酯类高分子的路线如图。
(1)下列有关A的说法正确的是___________ (填标号)。
a.无顺反异构体 b.实验式为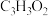
c.不能发生氧化反应 d.能与金属Na、NaOH和 反应
反应
(2)B中所含官能团的名称为___________ ,0.1molB最多可与___________ L(标准状况下) 发生加成反应。
发生加成反应。
(3)C→D的反应类型为___________ 。
(4)乙二醇的结构简式为___________ 。
(5)F→G的反应方程式为___________ 。
(6)J是E的同分异构体,符合下列条件的J的结构有___________ 种(不考虑立体异构)。
①不含 ;
;
②除苯环外不含其他环;
③能与 发生反应且0.1molJ最多可消耗0.2mol
发生反应且0.1molJ最多可消耗0.2mol 。
。
其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为___________ 。
(7)结合所学知识并参考上述合成路线,设计仅以 为碳源合成
为碳源合成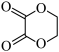 的路线
的路线___________ (无机试剂任选)。
(1)下列有关A的说法正确的是
a.无顺反异构体 b.实验式为
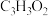
c.不能发生氧化反应 d.能与金属Na、NaOH和
 反应
反应(2)B中所含官能团的名称为
 发生加成反应。
发生加成反应。(3)C→D的反应类型为
(4)乙二醇的结构简式为
(5)F→G的反应方程式为
(6)J是E的同分异构体,符合下列条件的J的结构有
①不含
 ;
;②除苯环外不含其他环;
③能与
 发生反应且0.1molJ最多可消耗0.2mol
发生反应且0.1molJ最多可消耗0.2mol 。
。其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为
(7)结合所学知识并参考上述合成路线,设计仅以
 为碳源合成
为碳源合成 的路线
的路线
您最近一年使用:0次
3 . 为了减缓温室效应,实现碳中和目标,可将CO2转化为二甲醚、甲醇等产品。CO2与H2制二甲醚(CH3OCH3)的主要反应如下:
反应I:

反应II:
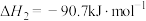
反应III:

反应IV:
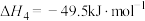
请回答下列问题:
(1)CO2(g)和H2(g)生成CH3OCH3(g)和H2O(g)的
___________ 。
(2)反应IV的反应历程如图所示(部分物质未画出)。___________ 。
(3)CO2在一定条件下催化加氢可生成CH3OH,主要发生三个反应(即反应I、II、III)。
①若在恒容密闭容器中只发生反应I,下列措施可提高H2平衡转化率的是___________ (填字母)。
a.加入催化剂 b.升高温度 c.充入惰性气体
②在某密闭容器中充入1molCO2、3molH2,在恒压(0.1MPa)下发生上述反应I、II、III,测得平衡时CO2的转化率和CH3OCH3的选择性随温度的变化如图所示。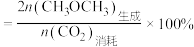 。
。
温度高于300℃时,曲线N随温度升高而升高的原因是___________ ;若Q点温度下CO的物质的量为0.08mol,则此时H2O的物质的量为___________ ,该温度下反应III的Kp=___________ (Kp为用压强表示的平衡常数,分压=总压×物质的量分数)。
反应I:


反应II:

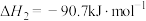
反应III:


反应IV:

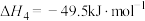
请回答下列问题:
(1)CO2(g)和H2(g)生成CH3OCH3(g)和H2O(g)的

(2)反应IV的反应历程如图所示(部分物质未画出)。

(3)CO2在一定条件下催化加氢可生成CH3OH,主要发生三个反应(即反应I、II、III)。
①若在恒容密闭容器中只发生反应I,下列措施可提高H2平衡转化率的是
a.加入催化剂 b.升高温度 c.充入惰性气体
②在某密闭容器中充入1molCO2、3molH2,在恒压(0.1MPa)下发生上述反应I、II、III,测得平衡时CO2的转化率和CH3OCH3的选择性随温度的变化如图所示。

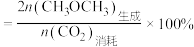 。
。温度高于300℃时,曲线N随温度升高而升高的原因是
您最近一年使用:0次
名校
解题方法
4 . 下图为合成氨以及氨氧化制硝酸的流程示意图。___________ 。
(2)请思考:A是什么物质___________ ,向吸收塔通入A的作用是___________ 。
(3)工业生产中为了罐装大量浓硝酸,可选择___________ 作为罐装材料。
a.镁 b.铜 c.铂 d.铝
(4)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的Na2CO3溶液等吸收尾气,后者使用NH3将氨氧化物还原为N2。请以尾气中NO2处理为例,分析以下问题。
①写出使用碱性的Na2CO3溶液吸收尾气的离子方程式___________ 。
②使用NH3还原尾气的反应中,如果尾气中含有的44.8LNO2(标准状况)被充分吸收,则消耗的氨气有___________ g。
(5)甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。___________ ;装置B内的试剂是___________ 。(写名称)
②在装置D中发生反应的还原剂与氧化剂的物质的量之比为___________ 。

(2)请思考:A是什么物质
(3)工业生产中为了罐装大量浓硝酸,可选择
a.镁 b.铜 c.铂 d.铝
(4)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的Na2CO3溶液等吸收尾气,后者使用NH3将氨氧化物还原为N2。请以尾气中NO2处理为例,分析以下问题。
①写出使用碱性的Na2CO3溶液吸收尾气的离子方程式
②使用NH3还原尾气的反应中,如果尾气中含有的44.8LNO2(标准状况)被充分吸收,则消耗的氨气有
(5)甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
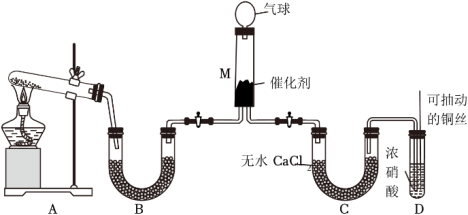
②在装置D中发生反应的还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是
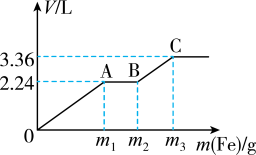
| A.产生H2的体积为2.24L |
| B.AB段发生的反应为:Fe3++Fe=2Fe2+ |
| C.参加反应的铁粉的总质量m3=8.4 |
| D.所用混合溶液中c(H2SO4)=2.0mol•L-1 |
您最近一年使用:0次
名校
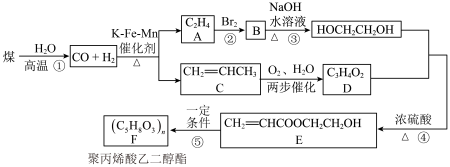
6 . 聚丙烯酸乙二醇酯是一种良好的水溶性涂料。工业上以煤为原料可设计合成路线如下:
(1)C的名称为___________ ,E中含氧官能团名称为___________ 。
(2)③的反应类型为___________ 。
(3)反应④的化学方程式为___________ 。
(4)反应⑤的化学方程式为___________ 。
(5)下列对图中有关物质的叙述正确的是___________ (填标号)。
a.煤的干馏是指在空气中加强热使其分解
b.化合物A和C互为同系物
c.化合物C中最多有7个原子在同一平面上
查阅资料获得信息: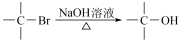
(1)C的名称为
(2)③的反应类型为
(3)反应④的化学方程式为
(4)反应⑤的化学方程式为
(5)下列对图中有关物质的叙述正确的是
a.煤的干馏是指在空气中加强热使其分解
b.化合物A和C互为同系物
c.化合物C中最多有7个原子在同一平面上
您最近一年使用:0次
名校
7 . 已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+  O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______ 。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:_______ 。
(3)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ΔH1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ΔH2 = -566.0 kJ·mol-1
①试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:_______
②甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用①中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸气时,放出的热量为_______ ,生成的CO2气体(标准状况下)体积是_______ ,转移电子_______ mol
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是_______
(5)已知C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ·mol-1,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石很容易进行,但此反应却很难发生,需要很高的温度和压强,请你对此分析并阐述原因_______
 O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:(1)CO的燃烧热ΔH=
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:
(3)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ΔH1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ΔH2 = -566.0 kJ·mol-1
①试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
②甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用①中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸气时,放出的热量为
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是
(5)已知C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ·mol-1,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石很容易进行,但此反应却很难发生,需要很高的温度和压强,请你对此分析并阐述原因
您最近一年使用:0次
名校
8 . 向容积为1.00L的密闭容器中通入一定量的N2O4和NO2的混合气体,发生反应:N2O4(g)⇌2NO2(g),体系中各物质浓度随时间变化如图。下列有关说法不正确的是

| A.到达化学平衡前,混合气体的颜色逐渐变深 |
| B.64s时N2O4和NO2的反应速率一定相等 |
| C.当v正(NO2)=2v逆(N2O4),反应达到化学平衡状态 |
| D.前100s内,用NO2浓度的变化表示的化学反应速率是0.008mol·L-1·s-1 |
您最近一年使用:0次
7日内更新
|
215次组卷
|
2卷引用:四川省内江二中2023-2024学年高一下学期期中考试化学试题
解题方法
9 . 为探究卤族元素单质及其化合物的性质设计了如下实验方案。由下列操作、现象能得出相应结论的是
操作 | 现象 | 结论 | |
| A | 向两份新制氯水中,分别滴加淀粉KI溶液和 溶液 溶液 | 前者溶液变蓝,后者溶液产生白色沉淀 | 氯气与水的反应存在限度 |
| B | 用玻璃棒蘸取“84”消毒液点在pH试纸上 | 试纸变白 | “84”消毒液呈中性 |
| C | 将少量 溶液滴入 溶液滴入 溶液中 溶液中 | 紫色很快褪去 | 氧化能力: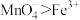 |
| D | 向碘的 溶液中加入等体积KI浓溶液,振荡、静置 溶液中加入等体积KI浓溶液,振荡、静置 | 分层,上层呈棕褐色,下层呈浅红色 | 碘在浓KI溶液中的溶解能力大于在 中的溶解能力 中的溶解能力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 用惰性电极电解法制备硼酸[ 或
或 ]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。已知
]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。已知 与
与 的性质相似。回答下列问题:
的性质相似。回答下列问题:____________ ;
(2)B、C膜分别是________________ ;(填“阳离子交换膜”或“阴离子交换膜”)
(3)b极的电极反应式为_____________ ;
(4)产品室中发生的反应离子方程式是______________ ;
(5)每增加1mol 产品,NaOH溶液增重
产品,NaOH溶液增重____________ g。
 或
或 ]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。已知
]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。已知 与
与 的性质相似。回答下列问题:
的性质相似。回答下列问题:
(2)B、C膜分别是
(3)b极的电极反应式为
(4)产品室中发生的反应离子方程式是
(5)每增加1mol
 产品,NaOH溶液增重
产品,NaOH溶液增重
您最近一年使用:0次



