名校
解题方法
1 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 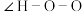 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: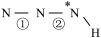 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
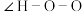 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: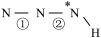 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
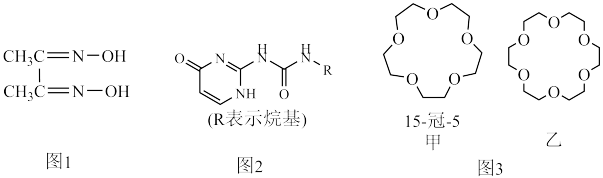
2 . 配合物和超分子广泛应用于新材料合成、物质的鉴别和分离。如丁二酮肟(如图1)可用于鉴别 Ni2+,嘧啶衍生物(如图2)是形成高韧性超分子的单体,冠醚(如图3)是皇冠状分子,可有大小不同的空穴适配不同大小的碱金属离子。
(1)基态 Ni2+核外未成对电子的数目为______ 。
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为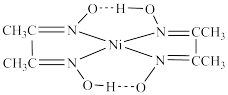 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为_______ 。
(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=_______ 。
(4)图2所示分子所含元素电负性由小到大的顺序为______ 。
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为________ ;乙的名称为______ 。
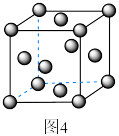
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为________ (用含π的代式表示)。
(1)基态 Ni2+核外未成对电子的数目为
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为
 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=
(4)图2所示分子所含元素电负性由小到大的顺序为
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为
您最近一年使用:0次
解题方法
3 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: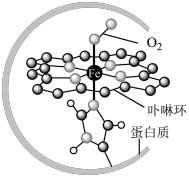
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
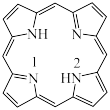
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。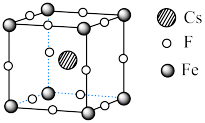
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
4 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
5 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: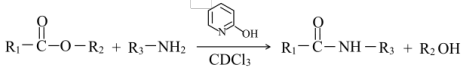 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
解题方法
6 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTC Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。
Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。C2H5OH的沸点高于CH3OCH3,原因是___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
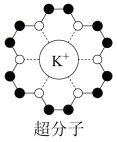
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
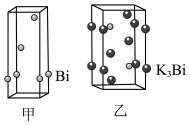
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
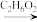 Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
Bi(NO3)3中阴离子的立体构型为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度
您最近一年使用:0次
名校
解题方法
7 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(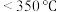 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(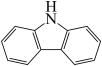 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(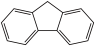 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
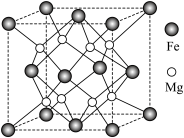
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(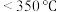 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
342次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
解题方法
8 . 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为________________ 。
②上述涉及的元素H、B 、C、N、O中电负性最大的是_____ (填元素符号)。
(2)BF3、NH3和PH3分子中键角由大到小的顺序为_____ 。
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=__________________ 。
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
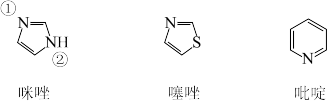
①上述三种物质中,沸点最高的是_____ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为_____________ 。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是_____ (填“①”或“②” )号氮原子。
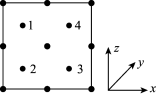
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为________ 。
(6)某铁氮化合物晶体的晶胞结构如图所示。
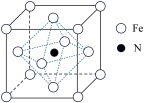
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_____ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3(列出计算式即可)。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为
②上述涉及的元素H、B 、C、N、O中电负性最大的是
(2)BF3、NH3和PH3分子中键角由大到小的顺序为
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:

①上述三种物质中,沸点最高的是
②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
(6)某铁氮化合物晶体的晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
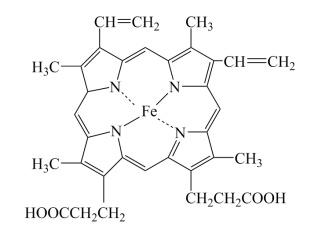
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(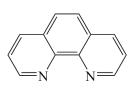 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
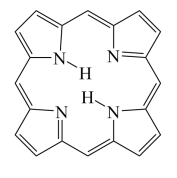
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1048次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
10 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
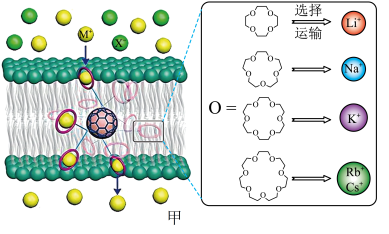
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
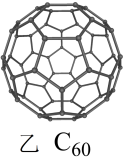
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
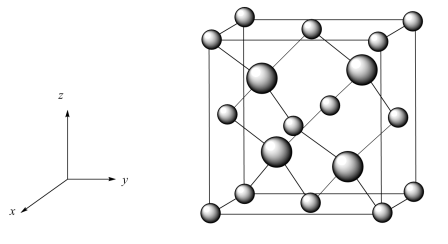
(5)铷晶胞为体心立方堆积,如图丙所示。
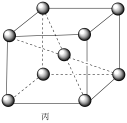
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
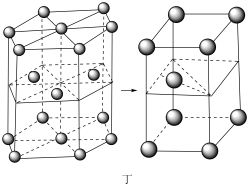
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次



