2023·河南·一模
1 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
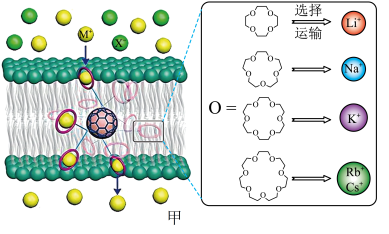
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
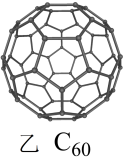
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
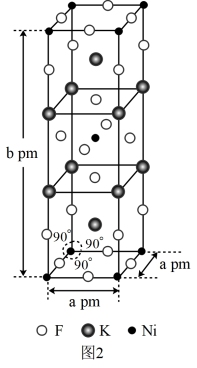
(5)铷晶胞为体心立方堆积,如图丙所示。
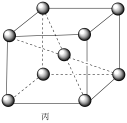
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
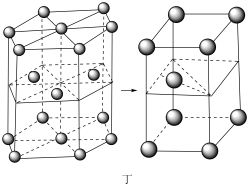
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
22-23高三上·福建泉州·阶段练习
名校
解题方法
2 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
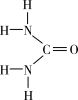
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中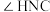
______________ 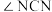 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
Ⅱ.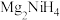 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。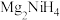 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
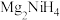 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。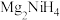 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
2022高三·全国·专题练习
3 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
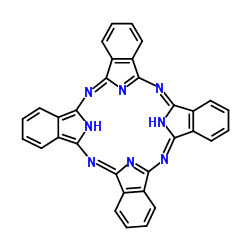
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(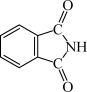 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
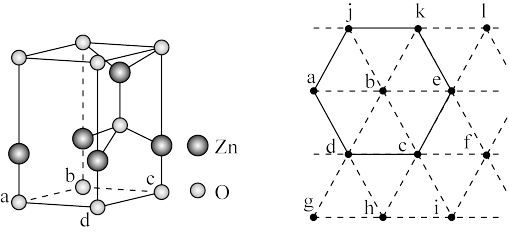
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
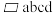 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9010次组卷
|
11卷引用:专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编
(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)2022年海南省高考真题变式题15-19(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)2022年海南省高考真题化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测
2022·四川攀枝花·模拟预测
解题方法
4 . 材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
(2)已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是_______。
(3)K3[Fe(CN)6]中所含元素电负性由大到小的顺序为_______ ,lmol K3[Fe(CN)6]含有_______ molσ键;Ti3+能形成化合物[TiCl(H2O)5]Cl2·H2O,该化合物中Ti3+的配位数为_______ 。
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:_______ 。
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在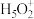 、
、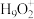 等微粒。
等微粒。
①H2O分子的键角小于H3O+离子的键角,原因是_______ 。
②画出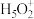 可能的一种结构式
可能的一种结构式_______ 。
(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。
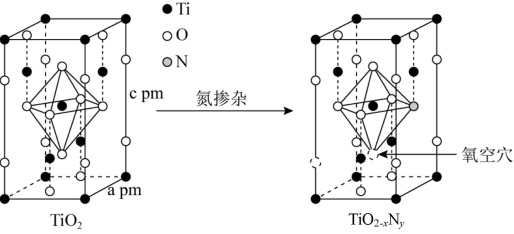
①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为_______ g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=_______ 。
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
A.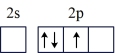 | B.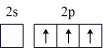 |
C.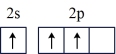 | D.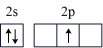 |
| A.Sc3+ | B.Cr3+ | C.Fe3+ | D.Zn2+ |
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在
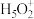 、
、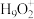 等微粒。
等微粒。①H2O分子的键角小于H3O+离子的键角,原因是
②画出
 可能的一种结构式
可能的一种结构式(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为
②图乙的结构可用化学式TiO2-xNy表示,其中x=
您最近一年使用:0次
2022·河南开封·模拟预测
5 . 最近科研人员发现,用[Ni(cyclam)]2+(结构如图a)作电催化剂、二茂铁(结构如图c)作为牺牲电子供体,NH4PF6作为电解质和质子供体,CH3CN作溶剂,可实现有效催化还原CO2。
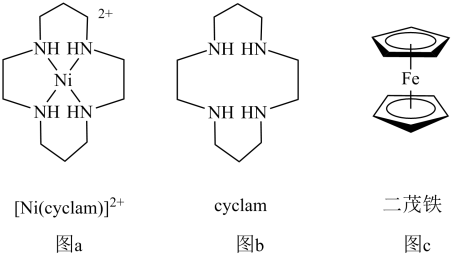
回答下列问题:
(1)基态Ni原子转化为基态Ni2+失去_______ 轨道的电子;基态Fe原子核外电子排布式为_______ 。
(2)NH4PF6中NH 空间构型为
空间构型为_______ ;N、P、F的电负性由大到小的顺序为_______ 。
(3)CH3CN分子中碳原子杂化方式为_______ 。
(4)已知3个及以上原子构成的离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子,连贯重叠在一起构成π型化学键,又称为大π键,可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为 。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为
。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为_______ 。
(5)[Ni (cyclam)]2+可由某些镍的化合物与cyclam 反应制得。[Ni(cyclam)]2+中,Ni2+的配位数为_______ ;cyclam可溶于水,而环十四烷不溶于水,其原因是_______ 。
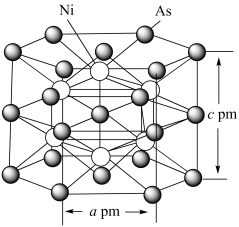
(6)某镍、砷晶体结构如图所示。该晶体的密度为_______ g·cm-3(列出计算式即可)。

回答下列问题:
(1)基态Ni原子转化为基态Ni2+失去
(2)NH4PF6中NH
 空间构型为
空间构型为(3)CH3CN分子中碳原子杂化方式为
(4)已知3个及以上原子构成的离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子,连贯重叠在一起构成π型化学键,又称为大π键,可用符号
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为 。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为
。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为(5)[Ni (cyclam)]2+可由某些镍的化合物与cyclam 反应制得。[Ni(cyclam)]2+中,Ni2+的配位数为
(6)某镍、砷晶体结构如图所示。该晶体的密度为

您最近一年使用:0次
6 . 一种无机纳米晶体材料,仅由铯、铅、溴三种元素构成,在太阳能电池方向有巨大应用前景。回答下列问题:
(1)基态 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为_______ 。 属于
属于_______ 区元素。
(2)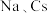 位于同主族,
位于同主族,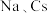 元素的第一电离能分别为
元素的第一电离能分别为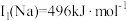 、
、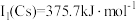 。
。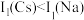 的原因是
的原因是_______ 。
(3) 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是_______ 。
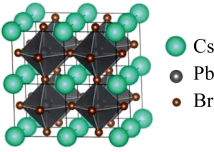
(4)该晶体材料的立方结构如图所示,其化学式为_______ 。若其晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度=_______  。
。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是_______ 。
②某大学采用 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,_______ (离子)脱离晶格,用 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是_______ 。
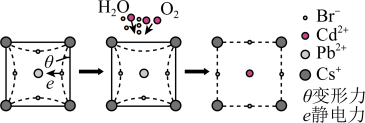
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
(1)基态
 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为 属于
属于(2)
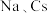 位于同主族,
位于同主族,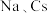 元素的第一电离能分别为
元素的第一电离能分别为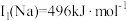 、
、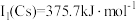 。
。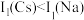 的原因是
的原因是(3)
 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是| 电负性 | ||
| F | Br | Pb |
| 4.0 | 2.8 | 1.9 |
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度= 。
。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是
②某大学采用
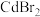 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,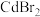 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
您最近一年使用:0次
2022·安徽淮北·二模
名校
解题方法
7 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
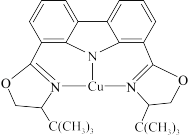
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
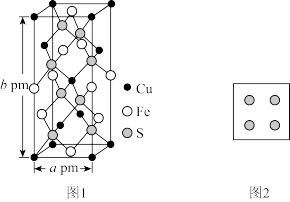
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
2022-05-04更新
|
732次组卷
|
4卷引用:专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)
(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)安徽省淮北市2022届高三第二次模拟考试理科综合化学试题山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题四川省南充高级中学2021-2022学年高二下学期期中考试化学试题
2022·陕西汉中·二模
名校
解题方法
8 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
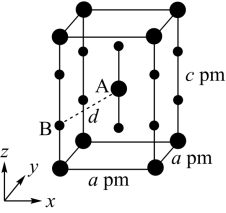
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)
(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
21-22高三下·海南海口·期中
9 . 我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
(1)基态Mn2+的电子排布式为[Ar]____ 。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为____ 。
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是____ 。
(3)CO(NH2)2中元素电负性由大到小的顺序为____ (用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为____ 。
(4)几种钛的卤化物的熔点如表所示:
钛的卤化物熔点呈上述变化的主要原因是____ 。
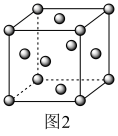
(5)一种钛的氧化物晶胞如图1所示,其化学式为____ 。
(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为____ g·cm-3(只列计算式即可)。
(1)基态Mn2+的电子排布式为[Ar]
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是
(3)CO(NH2)2中元素电负性由大到小的顺序为
(4)几种钛的卤化物的熔点如表所示:
| 卤化物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -25 | 39 | 150 |
(5)一种钛的氧化物晶胞如图1所示,其化学式为

(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为

您最近一年使用:0次
2022·湖南娄底·模拟预测
10 . 我国科学家预测全固态氟离子电池(CsPb1-xKxF3-x)可能替代锂离子电池。回答下列问题:
(1)基态K原子核外电子云轮廓图呈球形的能级上占据电子总数为_______ 。基态氟离子的电子排布式为_______ 。
(2)常见的含氟分子有HF、SiF4、OF2.其中,属于非极性分子的有_______ (填化学式),氟的电负性大于氯,但是HF的酸性比HCl的弱,其主要原因是_______ (提示:从分子间作用力角度分析)。
(3)我国科学家研究发现,在锂/氟化石墨电池中添加BF3,会提高能量转化效率。放电时,发生反应为LiF(s)+BF3(g)=LiBF4(aq),BF 的空间结构为
的空间结构为_______ ,上述反应中B原子的杂化类型变化为_______ 。
(4)CsF、KF的熔点分别为682℃、858℃,其熔点差异的主要原因是_______ 。
(5)铯、金、氯组成一种晶体,已知金元素有+1、+3价,它的晶胞如图1所示。大灰球为Cs,小黑球为Cl,其余球为Au。该晶体的化学式为_______ ,其中金原子有2种不同的化学环境,形成2种不同的离子,它们是_______ 和_______ 。
(6)铅单质的面心立方最密晶胞如图2所示。它的晶胞空隙率为_______ (用含π的式子表示;提示:晶胞空隙率=1- )。
)。
(1)基态K原子核外电子云轮廓图呈球形的能级上占据电子总数为
(2)常见的含氟分子有HF、SiF4、OF2.其中,属于非极性分子的有
(3)我国科学家研究发现,在锂/氟化石墨电池中添加BF3,会提高能量转化效率。放电时,发生反应为LiF(s)+BF3(g)=LiBF4(aq),BF
 的空间结构为
的空间结构为(4)CsF、KF的熔点分别为682℃、858℃,其熔点差异的主要原因是
(5)铯、金、氯组成一种晶体,已知金元素有+1、+3价,它的晶胞如图1所示。大灰球为Cs,小黑球为Cl,其余球为Au。该晶体的化学式为

(6)铅单质的面心立方最密晶胞如图2所示。它的晶胞空隙率为
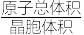 )。
)。
您最近一年使用:0次



