1 . 现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
| A.第一电离能:④>③>②>① | B.原子半径:①>②>③>④ |
| C.未成对电子数:④>③=②>① | D.电负性:④>③>②>① |
您最近一年使用:0次
2024-03-15更新
|
207次组卷
|
3卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
2 . 已知A、B、D、E、G、X、Y、Z八种元素的原子序数依次增大。其中,A原子核外电子只有1种运动状态;基态B、E原子的2p轨道均含2个未成对电子;G是周期表中电负性最大的元素;Y和G同主族,X和Y同周期,且X离子是同周期元素简单离子中半径最小的;Z是八种元素中唯一的第四周期元素位于ds区,且基态原子核外只有1个未成对电子其余均为成对电子。推断出元素符号及相应化学式,并回答下列问题:
(1)基态Z原子的简化核外电子排布式:_______ ,基态E原子价层电子轨道表达式:_______ ,基态X原子的核外电子排布共有_______ 个能级。
(2)键能:G-G_______ Y-Y(填“>或<”,后同);B和D的第三电离能:B_______ D。
(3)A2E分子的VSEPR理想模型为_______ ;已知DA3溶于A2E溶液呈碱性,试在方框内画出DA3与A2E的分子间形成的氢键_______ 。

(4)B2A2分子中σ键和π键的比例_______ ;B2A2、E2在NaOH溶液中可构建燃料电池,试写出该燃料电池负极的电极反应式:_______ 。
(1)基态Z原子的简化核外电子排布式:
(2)键能:G-G
(3)A2E分子的VSEPR理想模型为

(4)B2A2分子中σ键和π键的比例
您最近一年使用:0次
名校
3 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的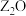 和黑色的
和黑色的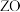 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。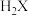 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)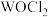 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向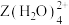 的溶液通入
的溶液通入 ,会生成
,会生成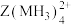 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的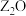 和黑色的
和黑色的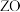 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是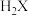 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
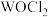 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
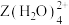 的溶液通入
的溶液通入 ,会生成
,会生成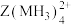 的原因是
的原因是
您最近一年使用:0次
解题方法
4 . 如图是元素①~⑥在元素周期表中的位置。
(1)①的原子结构示意图是___________ 。
(2)③在周期表中的位置是___________ 。
(3)③、④、⑤、⑥形成的简单离子中,半径最小的是___________ (填离子符号)。
(4)非金属性:②___________ ③(填“>”或“<”),从原子结构角度解释其原因___________ 。
(5)⑤的最高价氧化物的水化物可以与⑥的单质反应,请写出反应的离子方程式___________ 。
(6)下列关于①的说法正确的是___________ 。
a.在同主族元素中,①最高价氧化物的水化物的碱性最强
b.①在空气中加热生成的产物是过氧化物
c.①可以与水反应生成氢气
(7)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
x的范围是___________ 。请根据以上数据推测,在目前已知的118种元素中,电负性最大的元素为___________ (填元素符号)。
| ① | ② | ③ | ④ | ||||
| ⑤ | ⑥ | ||||||
(2)③在周期表中的位置是
(3)③、④、⑤、⑥形成的简单离子中,半径最小的是
(4)非金属性:②
(5)⑤的最高价氧化物的水化物可以与⑥的单质反应,请写出反应的离子方程式
(6)下列关于①的说法正确的是
a.在同主族元素中,①最高价氧化物的水化物的碱性最强
b.①在空气中加热生成的产物是过氧化物
c.①可以与水反应生成氢气
(7)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 | 铝 | 硅 | 磷 | 硫 | 氯 |
| 电负性 | 1.5 | 1.8 | 2.1 | x | 3.0 |
您最近一年使用:0次
名校
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态Y原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物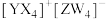 。下列叙述正确的是
。下列叙述正确的是
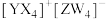 。下列叙述正确的是
。下列叙述正确的是A.氧化性: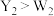 | B.电负性:Y>X>Z |
| C.Y的含氧酸一定是强酸 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-12-30更新
|
480次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2023-2024学年高一上学期1月期末化学试题
6 .  和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实不能 从元素的电负性角度解释的是
 和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实A.熔点: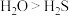 | B.还原性: |
C.沸点: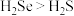 | D. 中H为+1价 中H为+1价 |
您最近一年使用:0次
2023-12-14更新
|
70次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
7 . 光伏材料又称太阳能材料,能将太阳能直接转换成电能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CaS、CdTe、CuInSe等。
(1)元素铜在元素周期表中位于___________ 区,基态铬(Cr)原子的价电子轨道表示式为___________ 。
(2)P、S、Cl元素的电负性从大到小的顺序为___________ ,其中电负性最小的元素原子价电子排布式为___________ 。
(3)As元素的第一电离能___________ (填“大于”“小于”或“等于”)Se元素的第一电离能,原因是___________ 。
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲合能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中,除了氮元素外,其他元素的
变化趋势如图所示,其中,除了氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是___________ ;氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。
(1)元素铜在元素周期表中位于
(2)P、S、Cl元素的电负性从大到小的顺序为
(3)As元素的第一电离能
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲合能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中,除了氮元素外,其他元素的
变化趋势如图所示,其中,除了氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
您最近一年使用:0次
2023-12-13更新
|
426次组卷
|
3卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题
8 . “嫦娥石”是中国首次在月球上发现的新矿物,其主要由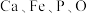 和
和 (钇,原子序数比
(钇,原子序数比 大13)组成,下列说法正确的是
大13)组成,下列说法正确的是
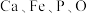 和
和 (钇,原子序数比
(钇,原子序数比 大13)组成,下列说法正确的是
大13)组成,下列说法正确的是| A.Y位于元素周期表的第ⅢB族 |
B.基态 原子的核外电子填充在6个轨道中 原子的核外电子填充在6个轨道中 |
C.5种元素中,第一电离能最小的是 |
D.5种元素中,电负性最大的是 |
您最近一年使用:0次
2023-09-28更新
|
4670次组卷
|
6卷引用:湖北省武汉市华中师范大学第一附属中学2023-2024学年高一下学期4月期中考试化学试题
湖北省武汉市华中师范大学第一附属中学2023-2024学年高一下学期4月期中考试化学试题2023年重庆市高考化学试卷(已下线)选择题6-10(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
名校
解题方法
9 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近一年使用:0次
2023-07-29更新
|
112次组卷
|
6卷引用:【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题
【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于___________ 区,Cu2+价电子排布式为___________ 。
(2)邻氨基吡啶(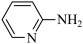 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为___________ ;1mol 中σ键的数目为
中σ键的数目为___________ 。邻氨基吡啶的铜配合物结构简式如下图所示,C原子轨道杂化类型为___________ 。
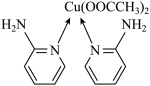
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是___________ 。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是___________ 。
(1)Cu在周期表中位于
(2)邻氨基吡啶(
 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 中σ键的数目为
中σ键的数目为
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是
您最近一年使用:0次
2023-07-05更新
|
212次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一下学期期末考试化学试题



