名校
1 . 助力神舟十三号载人飞船顺利飞向太空的运载火箭发动机以偏二甲肼和液态 为主要燃料,工作时发生的反应为:
为主要燃料,工作时发生的反应为: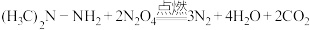 。下列有关说法错误的是
。下列有关说法错误的是
 为主要燃料,工作时发生的反应为:
为主要燃料,工作时发生的反应为: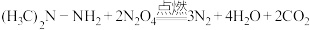 。下列有关说法错误的是
。下列有关说法错误的是A.偏二甲肼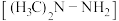 分子中C、N原子的杂化方式不同 分子中C、N原子的杂化方式不同 |
| B.H、C、N、O电负性依次增大 |
| C.C、N、O第一电离能由大到小的顺序为:N、O、C |
D.等物质的量的 、 、 分子含有相同数目的 分子含有相同数目的 键 键 |
您最近一年使用:0次
2023-05-07更新
|
106次组卷
|
2卷引用:河北省唐县第一中学2022-2023学年高二下学期5月月考化学试题
2 . X、Y、Z、W为原子序数依次增大的短周期主族元素,XZ能腐蚀玻璃;W与Y同族,且W的原子序数是Y的两倍。四种元素形成的化合物有如下反应: 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是| A.原子半径:W>Y>Z>X |
| B.简单氢化物的还原性:W>Y>Z |
| C.电负性:Z>Y>W>X |
D. 中W原子的杂化轨道类型为 中W原子的杂化轨道类型为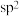 |
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、W是短周期原子序数依次增大的四种常见主族元素,其原子结构及元素的性质见下表:
下列表达不正确的是
| X | Y | Z | W |
| 其单质有多种同素异形体,一种是自然界中最硬的物质 | 该元素的最高价氧化物的水化物与其气态氢化物生成离子化合物 | 原子序数比Y大2 | 主族序数是周期序数的2倍 |
| A.价电子数:Z>W>Y>X | B.最高价氧化物的水化物的酸性:W<X |
| C.X、Y、Z的第一电离能逐渐增大 | D.X、Y、Z的电负性逐渐增大 |
您最近一年使用:0次
2021-03-17更新
|
236次组卷
|
3卷引用:河北省武安市第三中学2021-2022学年高二上学期第二次月考化学试题
4 . 甲醛检测试剂盒常用来检测室内空气中甲醛,其原理是甲醛与MBTH反应生成物质A,物质A再发生一系列反应,最终生成蓝绿色化合物,有关转化如图。下列说法正确的是


| A.上述有机物涉及的元素中氮元素的电负性最强 |
| B.甲醛分子结构为平面三角形 |
| C.物质A中的C、N、S一定位于同一个平面内 |
| D.1molMBTH中σ键的数目为22NA |
您最近一年使用:0次
5 . 有机物M(如图所示)是合成某新型绿色农药的中间体,下列说法正确的是
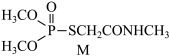
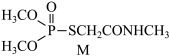
A.中子数为8的碳原子: | B.电负性: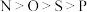 |
C.碳原子的杂化方式为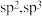 | D.简单离子半径: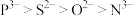 |
您最近一年使用:0次
2023-04-24更新
|
121次组卷
|
3卷引用:河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题
11-12高二下·河北衡水·期末
名校
6 . 以下有关元素性质的说法不正确的是
| A.具有下列电子排布式①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4的原子中,原子半径最大的是① |
| B.具有下列价电子排布式①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4的原子中,第一电离能最大的是③ |
| C.①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而增大的是③ |
| D.某主族元素基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703…,当它与氯气反应时生成的阳离子是X3+ |
您最近一年使用:0次
2018-12-03更新
|
589次组卷
|
11卷引用:河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题
河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)2011-2012学年河北省衡水中学高二下学期期末考试化学试卷2014-2015湖北省襄阳市五中高二3月月考化学试卷河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题吉林省松原市扶余县第一中学2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质(已下线)2018年11月26日 《每日一题》一轮复习-元素性质的递变规律山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题辽宁省六校2021届高三上学期期中联考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)
7 . 重水是含有较多 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:
(1)画出Ca原子的原子结构示意图___________ ,硫元素在元素周期表的位置___________ ,属于___________ 区。
(2)写出基态N原子的电子排布式___________ ,画出基态O原子的价电子排布图___________ 。基态N原子的第一电离能比O原子的要大的原因是___________ 。
(3)若将基态镁原子最高能级的电子排布图表示为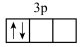 ,则它违背的电子排布规律是
,则它违背的电子排布规律是___________ 、___________ ,基态硫原子核外电子所处最高能级轨道的形状为___________ 。
(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
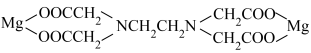
其中C、N、O、Mg四种元素的电负性由大到小的顺序是___________ ,原子半径最大的是___________ (填元素符号,下同),四种元素中基态原子核外单电子数最多的是___________ 。
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式___________ 、___________ 。
 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:(1)画出Ca原子的原子结构示意图
(2)写出基态N原子的电子排布式
(3)若将基态镁原子最高能级的电子排布图表示为
 ,则它违背的电子排布规律是
,则它违背的电子排布规律是(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
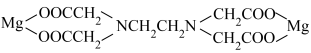
其中C、N、O、Mg四种元素的电负性由大到小的顺序是
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式
您最近一年使用:0次
名校
解题方法
8 . 钡的单质和化合物在生产生活中有重要的应用。请回答下列问题:
(1)钡元素是第6周期的碱土金属元素,其基态原子的外围电子轨道表示式为_______ 。
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序是_______ ,SO 的空间构型是
的空间构型是_______ ,中心原子S的杂化方式是_______ 。
(3)部分碱土金属氧化物的熔点如下表所示:
由表中数据可知,该族元素氧化物熔点的变化规律是_______ ,产生这种规律的原因是_______ 。
(4)氯化钡的玻恩哈伯循环如下图所示:

①由图可知,Cl-Cl的键能为_______ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),则氯元素的第一电子亲和能E1=_______ 。
(5)已知氟化钡的晶胞符合萤石结构(见下图)。

①若将M和N两点的原子分数坐标分别定义为(0,0,0)和(0, ,
, ),则下列坐标为F-分数坐标的是
),则下列坐标为F-分数坐标的是_______ 。
A.(0, ,
, ) B.(
) B.( ,
, ,
, ) C.(
) C.( ,
, ,
, ) D.(
) D.( ,
, ,
, )
)
②若晶胞中两个相邻且距离最近的Ba2+的核间距为apm,则氟化钡的密度ρ=_______ g·cm-3(列出计算式,不必化简)。
(1)钡元素是第6周期的碱土金属元素,其基态原子的外围电子轨道表示式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序是
 的空间构型是
的空间构型是(3)部分碱土金属氧化物的熔点如下表所示:
| 碱土金属氧化物 | MgO | CaO | SrO | BaO |
| 熔点/°C | 2800 | 2576 | 2430 | 1923 |
由表中数据可知,该族元素氧化物熔点的变化规律是
(4)氯化钡的玻恩哈伯循环如下图所示:

①由图可知,Cl-Cl的键能为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),则氯元素的第一电子亲和能E1=
(5)已知氟化钡的晶胞符合萤石结构(见下图)。

①若将M和N两点的原子分数坐标分别定义为(0,0,0)和(0,
 ,
, ),则下列坐标为F-分数坐标的是
),则下列坐标为F-分数坐标的是A.(0,
 ,
, ) B.(
) B.( ,
, ,
, ) C.(
) C.( ,
, ,
, ) D.(
) D.( ,
, ,
, )
)②若晶胞中两个相邻且距离最近的Ba2+的核间距为apm,则氟化钡的密度ρ=
您最近一年使用:0次
名校
解题方法
9 . VCU研发的锂超离子导体Li3SBF4,提升了固态电解质导电性,其制备反应为LiBF4+Li2S=Li3SBF4。
回答下列问题:
(1)基态硫原子中核外电子有____ 种运动状态;组成锂超离子导体的四种元素中,电负性最大的元素的价层电子排布式为____ 。
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是____ (填化学式),该分子的中心原子的价层电子对数是____ ;含F有机酸CF3COOH比CCl3COOH的酸性____ (填“强”或“弱”),原因为____ 。
(3)BF3与F-形成 时,二者形成的化学键为
时,二者形成的化学键为____ 键,提供电子对的原子为____ (填元素符号), 中B的杂化方式为
中B的杂化方式为____ 。
(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为___ 、___ ;设NA为阿伏加德罗常数的值,LiFePO4的密度ρ=___ g•cm-3(用含a、b、c、NA的代数式表示)。
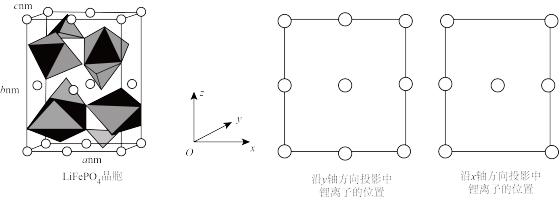
回答下列问题:
(1)基态硫原子中核外电子有
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是
(3)BF3与F-形成
 时,二者形成的化学键为
时,二者形成的化学键为 中B的杂化方式为
中B的杂化方式为(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为

您最近一年使用:0次
名校
解题方法
10 . X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,由其组成化合物的结构如图所示,Q的原子最外层电子数是电子层数的3倍,下列说法正确的是


| A.原子半径:W>Q>Z>Y>X |
| B.Z2X4中既有极性键,又有非极性键 |
| C.电负性:Z>Q>Y |
| D.W、Q形成的二元化合物与X2Q、YQ2反应都是氧化还原反应 |
您最近一年使用:0次
2023-06-26更新
|
102次组卷
|
2卷引用:河北省石家庄市河北师范大学附属实验中学2024届高三上学期10月月考化学试题



