解题方法
1 . NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.H2O 的稳定性大于 H2S,是因为 H2O分子间存在氢键 |
| B.1~36 号元素中,基态原子未成对电子数最多的元素是 Cr |
| C.主族元素的电负性越大,元素原子的第一电离能一定越大 |
D.1 mol丙酮(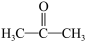 )分子中含有σ键的数目为 8NA )分子中含有σ键的数目为 8NA |
您最近一年使用:0次
2021-02-01更新
|
244次组卷
|
3卷引用:3.4.1分子间作用力 课后
名校
解题方法
2 . 最近我国科研人员发现了一种安全、高效的点击化学试剂FSO2N3,下列有关元素F、S、O、N的说法正确的是
| A.电负性:F>O>N>S |
| B.第一电离能:F>S>O>N |
| C.最高正价:F>S=O>N |
| D.S原子的基态原子核外未成对电子数最多 |
您最近一年使用:0次
2020-12-19更新
|
1324次组卷
|
8卷引用:2.2.2元素第一电离能和电负性的周期性变化 课后
2.2.2元素第一电离能和电负性的周期性变化 课后山东省百所名校2021届高三12月联考化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)山东省部分省重点中学2021届高三第二次质量监测联考化学试题江苏省溧水高级中学2020-2021学年高二下学期4月调研化学试题山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)专题2 原子结构与元素性质 ★第二单元综合拔高练第一章原子结构与性质(提升卷)
名校
解题方法
3 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
341次组卷
|
9卷引用:2.2.2元素第一电离能和电负性的周期性变化 课后
2.2.2元素第一电离能和电负性的周期性变化 课后(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题四川省西充中学 2021-2022 学年高二上学期期中考试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
4 . 在下列横线上,填上适当的元素符号:
(1)在第三周期中,第一电离能最小的元素是_________ ,第一电离能最大的元素是______ 。
(2)在元素周期表中,电负性最大的元素是_______ ,电负性最小的元素是_________ (放射性元素除外)。
(3)最活泼的金属元素是_______ 。
(4)最活泼的非金属元素是______ 。
(5)第二、三、四周期元素中p轨道半充满的原子是_______ 。
(6)电负性相差最大的两种元素是________ (放射性元素除外)。
(1)在第三周期中,第一电离能最小的元素是
(2)在元素周期表中,电负性最大的元素是
(3)最活泼的金属元素是
(4)最活泼的非金属元素是
(5)第二、三、四周期元素中p轨道半充满的原子是
(6)电负性相差最大的两种元素是
您最近一年使用:0次
2020-04-09更新
|
172次组卷
|
5卷引用:1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2
1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)(已下线)1.3.2 元素的电负性及其变化规律-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
解题方法
5 . 不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
(1)通过分析X值的变化规律,确定 、
、 的X值范围:
的X值范围:______ 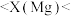
______ ;______ 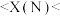
______ 。
(2)推测X值与原子半径的关系为______ 。
(3)某有机化合物的结构为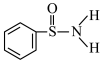 ,其中
,其中 键中,你认为共用电子对偏向
键中,你认为共用电子对偏向______ (填元素符号)。
(4)如果X值为电负性的数值,试推断 中化学键的类型为
中化学键的类型为______ 。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______ (填元素符号)。
| 元素符号 |  |  |  |  |  |  |
| X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素符号 |  |  |  |  |  |  |
| X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
 、
、 的X值范围:
的X值范围: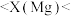
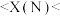
(2)推测X值与原子半径的关系为
(3)某有机化合物的结构为
 ,其中
,其中 键中,你认为共用电子对偏向
键中,你认为共用电子对偏向(4)如果X值为电负性的数值,试推断
 中化学键的类型为
中化学键的类型为(5)预测元素周期表中X值最小的元素(放射性元素除外)是
您最近一年使用:0次
2020-03-05更新
|
486次组卷
|
5卷引用:2.2.2元素第一电离能和电负性的周期性变化 课中
名校
6 . 下列说法不正确的是( )
| A.同族元素在性质上的相似性,取决于原子价电子排布的相似性 |
| B.第一电离能越小,表示气态时该原子越易失去电子 |
| C.元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D.电负性大的元素易呈现正价,电负性小的元素易呈现负价 |
您最近一年使用:0次
2019-05-06更新
|
159次组卷
|
6卷引用:1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2
1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2(已下线)2012年人教版高中化学选修3 1.2原子结构与元素的性质练习卷山东省单县五中2017-2018学年高二下学期第一次月考化学试题湖北省宜昌市葛洲坝中学2018-2019学年高二下学期期中考试化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)
7 . 利用元素的电负性不能判断的是
| A.元素原子的得电子能力 | B.化学键的类别(离子键和共价键) |
| C.元素的活泼性 | D.元素的稳定化合价 |
您最近一年使用:0次
2019-04-10更新
|
307次组卷
|
6卷引用:2.2.2元素第一电离能和电负性的周期性变化 课中
2.2.2元素第一电离能和电负性的周期性变化 课中(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时2 元素周期律——原子半径、电离能、电负性的递变规律(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化(已下线)2019年4月9日 《每日一题》选修3-电离能和电负性的应用
真题
名校
8 . 在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
| A.Li,F | B.Na,F | C.Na,Cl | D.Mg,O |
您最近一年使用:0次
2019-01-30更新
|
743次组卷
|
19卷引用:2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2
2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2上海中学东校2023-2024学年高三上学期9月月考化学试题2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2013-2014河北省唐山一中下学期高二期末考试化学试卷2015-2016学年陕西省西安高中高二下期末化学试卷【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)(已下线)模块同步卷06 阶段性检测卷-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省福州高级中学2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题四川省绵阳中学2022-2023学年高二上学期9月线上测试化学试题
名校
9 . 下列晶体中,金属阳离子与“自由电子”间的作用最强的是
A.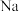 | B.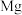 | C. | D. |
您最近一年使用:0次
2019-01-12更新
|
463次组卷
|
8卷引用:3.1.1金属键与金属特性 课后
3.1.1金属键与金属特性 课后(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 第1课时 金属键与金属晶体鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第1课时 金属晶体(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 课时1 金属键与金属晶体(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第3节 离子键、配位键与金属键专题3 微粒间作用力与物质性质 第一单元 金属键 金属晶体 第1课时 金属键与金属特性浙江省宁波市北仑中学2022-2023学年高二下学期期中考试化学试题河北省曲周县第一中学2018-2019学年高二上学期12月月考化学试题
10 . Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键__________ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有______ (填序号)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3 [Cu(NH3)4]2++2OH-。其原因是
[Cu(NH3)4]2++2OH-。其原因是_________________ 。
(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。
①H、O、N三种元素的电负性从大到小的顺序为___________ 。
②乙二胺分子中N原子成键时采取的杂化类型是__________ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3
 [Cu(NH3)4]2++2OH-。其原因是
[Cu(NH3)4]2++2OH-。其原因是(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。①H、O、N三种元素的电负性从大到小的顺序为
②乙二胺分子中N原子成键时采取的杂化类型是
您最近一年使用:0次
2018-12-03更新
|
605次组卷
|
5卷引用:2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2



