名校
解题方法
1 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一、回答:
(1)镍基态原子有___________ 种不同空间运动状态的电子,第四周期与基态镍原子单电子数相同的元素有___________ 种(不含镍元素)。
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键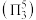 。
。 键角
键角___________ 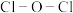 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中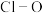 键的键长并说明原因
键的键长并说明原因___________ 。
(4)人类合成的第一个稀有气体化合物是XeF+PtF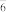 ,PtF
,PtF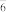 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在氧原子围成的___________ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为___________ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
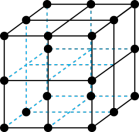
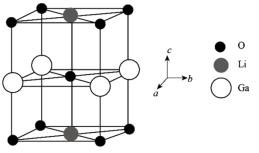
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
①上述晶胞沿着a轴的投影图为___________ (填字母)。
A. B.
B.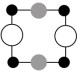 C.
C.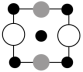
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为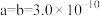 m,
m,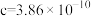 m,则其密度为
m,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)镍基态原子有
(2)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。0.2mol二丁二酮肟合镍分子内含有σ键

a.sp3和sp2 b.sp2和 sp2 c.sp2和p d.sp3和p
(3)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键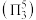 。
。 键角
键角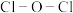 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)人类合成的第一个稀有气体化合物是XeF+PtF
 ,PtF
,PtF 中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。
中的键角有90°和180°两种。下列关于该化合物的说法中正确的是___________。| A.熔化状态下不能导电 |
| B.XeF+中所有原子都满足8电子稳定结构 |
| C.用两个Cl替换F后,所得PtF4Cl2有两种结构 |
| D.含有离子键、极性键、非极性键和配位键 |
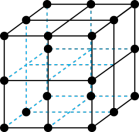
(6)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为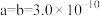 m,
m,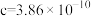 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
名校
2 . 下列说法中错误的是
A.根据水的沸点高于氟化氢,推断分子间氢键数目: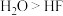 |
B.根据推电子基团种类不同,推断酸性: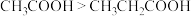 |
C.根据核外电子数不同,推断核外电子空间运动状态种类: |
D.根据中心原子电负性不同,推断键角: |
您最近半年使用:0次
2024-01-13更新
|
1041次组卷
|
6卷引用:宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
3 . 法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法正确的是
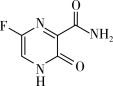

| A.该分子中C原子均为sp2杂化 |
| B.该分子中C—N键的键能大于C—F键的键能 |
| C.该分子中σ键与π键数目之比为7:2 |
| D.该分子中存在手性碳原子 |
您最近半年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是___________ (填字母)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了以下平衡: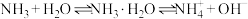
d.NH3是一种易液化的气体
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成 。根据氨水的性质推知
。根据氨水的性质推知 的结构式为
的结构式为___________ 。(填字母)
a. b.
b.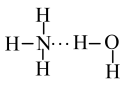 b. c.
b. c. d.
d.
(2)第ⅤA族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示。则Y轴可表示的氢化物(RH3)性质可能是___________。(填字母)

(3)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___________
(4)氮、磷、砷为同主族元素,As4O6的分子结构如图所示,其中As原子的杂化方式为___________ ,1 mol As4O6含有σ键的物质的量为___________ 。

(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是___________ (填“极性”或“非极性”)分子。
(6)NH 中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是___________ 。
(1)NH3在水中的溶解度是常见气体中最大的。
①下列因素与NH3的水溶性没有关系的是
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了以下平衡:
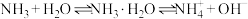
d.NH3是一种易液化的气体
②NH3溶于水时,大部分NH3与H2O通过氢键结合形成
 。根据氨水的性质推知
。根据氨水的性质推知 的结构式为
的结构式为a.
 b.
b.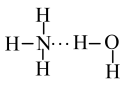 b. c.
b. c. d.
d.
(2)第ⅤA族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示。则Y轴可表示的氢化物(RH3)性质可能是___________。(填字母)

| A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(4)氮、磷、砷为同主族元素,As4O6的分子结构如图所示,其中As原子的杂化方式为

(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)NH
 中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
中的H-N-H的键角比 NH3中的H-N-H的键角大, 原因是
您最近半年使用:0次
名校
解题方法
5 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(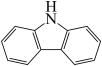 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(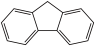 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
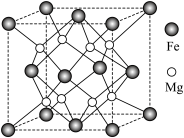
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(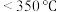 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近半年使用:0次
2023-05-25更新
|
337次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
名校
6 . 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是:

| A.I中O元素的第一电离能最大 |
| B.1个Ⅱ分子中含有9个σ键 |
| C.Ⅲ中碳氧键的键能均相等 |
| D.该反应催化剂基态的价层电子排布式为3d10 |
您最近半年使用:0次
2023-01-13更新
|
550次组卷
|
4卷引用:宁夏银川一中2022-2023学年高二下学期期中考试化学试题
宁夏银川一中2022-2023学年高二下学期期中考试化学试题天津市新华中学2022-2023学年高三上学期期末考试化学试题(已下线)专题6 点击化学反应——化学学科发展前沿江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
名校
解题方法
7 . 由徐光宪院士发起院士学子同创的《分子共和国》科普读物生动形象地戏说了BF3、NH3、H2S、O3、CH3COOH、SOCl2等众多“分子共和国”中的明星。下列说法正确的是
| A.键角:NH3<BF3 |
| B.酸性:CH3COOH>CF3COOH |
| C.SOCl2分子中只存在σ键,不存在π键 |
| D.H2S、O3分子的空间结构均为直线形,且均为非极性分子 |
您最近半年使用:0次
2022-10-27更新
|
1163次组卷
|
14卷引用:宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题
宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题广东省云浮市2021-2022学年高二下学期期末教学质量检测化学试题湖北省恩施州高中教育联盟2021-2022学年高二下学期期末考试化学试题广东省梅州市梅江区梅州中学2022-2023学年高三上学期8月阶段性考试化学试题河北省石家庄市第九中学2022-2023高三上学期10月月考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第二次月考化学试题(已下线)第37讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题七 非金属元素及其化合物-实战高考·二轮复习核心突破广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题 广东省广州市第六中学2022-2023学年高二下学期期末考试化学试题(已下线)第05讲 分子结构与物质的性质-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)热点05 分子结构与物质的性质四川省达州市万源中学2023-2024学年高二下学期4月月考化学试题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
8 . 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素形成的化合物甲的结构为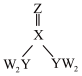 ,其中各原子的最外层均处于稳定结构。W与X、Y、Z均可形成电子数相等的分子,
,其中各原子的最外层均处于稳定结构。W与X、Y、Z均可形成电子数相等的分子,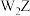 常温常压下为液体。下列说法正确的是
常温常压下为液体。下列说法正确的是
A.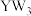 分子中的键角为120° 分子中的键角为120° | B.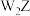 的稳定性大于 的稳定性大于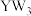 |
| C.物质甲的1个分子中存在6个σ键 | D.Y元素的氧化物对应的水化物为强酸 |
您最近半年使用:0次
2022-08-28更新
|
3152次组卷
|
18卷引用:宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题
宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题山东省泰安市2020届高三一轮检测试题化学试题山东省泰安市2020届高三第三次模拟试卷化学试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题全书综合评测(已下线)第30讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省东莞市第四高级中学2022-2023学年高二上学期期中考试化学试题陕西省西安市铁一中学2022-2023学年高三上学期1月期末考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题广东省东莞市七校2022-2023学年高二上学期(12月)期中考试化学试题广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题福建省泉州市铭选中学 泉州九中 侨光中学三校2022-2023学年高二下学期7月期末化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题(已下线)第二章 分子结构与性质(A卷)上海市华东师范大学附属东昌中学2023-2024学年高三上学期第四次测试化学试卷贵州省安龙县第一中学2023-2024学年高二下学期第一次阶段考试化学试题
名校
解题方法
9 . 下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 选项 | 表述1 | 表述2 |
| A | 在水中, 的溶解度比 的溶解度比 的溶解度大 的溶解度大 |  晶体中 晶体中 与 与 间的作用力大于碘晶体中分子间的作用力 间的作用力大于碘晶体中分子间的作用力 |
| B | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| C | 通常条件下, 分子比 分子比 分子稳定性强 分子稳定性强 |  的原子半径比C的大, 的原子半径比C的大, 与H之间的键能比C与H之间的键能小 与H之间的键能比C与H之间的键能小 |
| D |  、 、 溶于水后均不导电 溶于水后均不导电 |  、 、 均属于共价化合物 均属于共价化合物 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-05-01更新
|
396次组卷
|
14卷引用:宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题
宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题(已下线)2011-2012学年山西省忻州一中高二下学期第一次月考化学试卷福建省厦门市湖滨中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题陕西省西安市长安区第一中学2020-2021学年高二上学期第二次月考化学试题辽宁省朝阳市第一高级中学2020-2021学年高二上学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题广东省广州市(广大附,铁一,广外)三校2021-2022学年高二下学期期中联考化学试题江苏省苏州市2021-2022学年高二上学期期末模块测评化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题
名校
10 . Ⅰ.图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水。向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝。

(1)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是_______ 。
Ⅱ.硫酸铜可应用于电镀、颜料、医药、农药等方面。如图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:
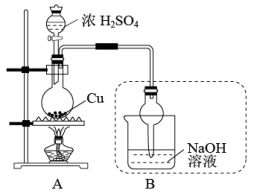
完成下列填空:
(2)图中盛放浓H2SO4的玻璃仪器名称是_______ 。写出图中装置B的作用: _______ 。
Ⅲ.[Cu(NH3)4]SO4·H2O晶体制备:
(3)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;再加入适量乙醇,将析出[Cu(NH3)4]SO4·H2O晶体。请解释加入乙醇后析出晶体的原因_______ 。
(4)写出沉淀溶解得透明溶液的离子方程式_______ 。
(5)1mol[Cu(NH3)4]SO4含有_______ molσ键。
(6)从结构的角度分析NH3比NF3的键角大的原因:_______ 。

(1)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是
Ⅱ.硫酸铜可应用于电镀、颜料、医药、农药等方面。如图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:

完成下列填空:
(2)图中盛放浓H2SO4的玻璃仪器名称是
Ⅲ.[Cu(NH3)4]SO4·H2O晶体制备:
(3)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;再加入适量乙醇,将析出[Cu(NH3)4]SO4·H2O晶体。请解释加入乙醇后析出晶体的原因
(4)写出沉淀溶解得透明溶液的离子方程式
(5)1mol[Cu(NH3)4]SO4含有
(6)从结构的角度分析NH3比NF3的键角大的原因:
您最近半年使用:0次



